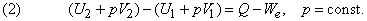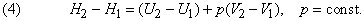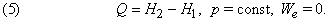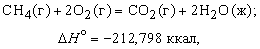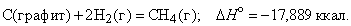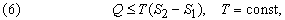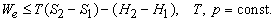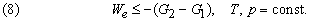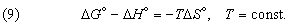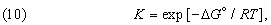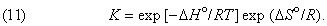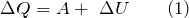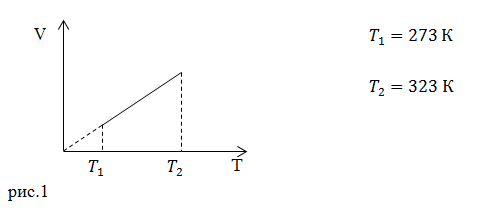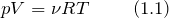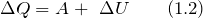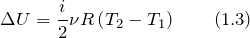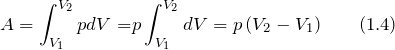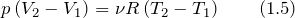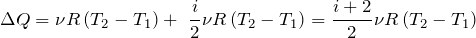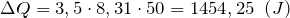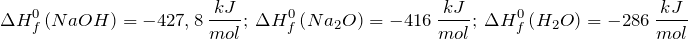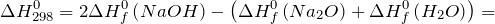Конспект лекции на тему «Химическая термодинамика»
ЛЕКЦИЯ № 4 ПОНЯТИЕ О ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Термодинамика – это наука, изучающая превращения одних видов энергии в другие. Изучением этих превращений, применительно к химическим реакциям и физико-химическим процессами занимается химическая термодинамика.
Химические процессы могут протекать с поглощением или выделением энергии, причем эта энергия может поглощаться или выделяться в виде теплоты, света, электричества. Чаще всего это тепловая энергия. Раздел химии, изучающий тепловые эффекты химических реакций, называется термохимией.
Количество тепла, которое может выделяться или поглощаться в химическом процессе, называется тепловым эффектом реакции Q. Тепловой эффект реакции выражается в КДж/моль. В зависимости от знака Q различают экзотермические и эндотермические реакции.
Экзотермические реакции протекают с выделением теплоты (Q>0). В них внутренняя энергия реагирующих частиц переходит в тепловую энергию окружающей среды.
Эндотермические реакции с поглощением теплоты (Q
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями. В термохимических уравнениях указывается фазовое состояние реагирующих и образующихся веществ, а стехиометрические коэффициенты могут быть дробными.
Выделение теплоты при взаимодействии различных веществ указывает на то, что эти вещества еще до реакции в скрытой форме обладали определенным запасом энергии. Такая форма энергии, высвобождающаяся в ходе химических реакций и физических процессах, называется внутренней энергией U . Внутренняя энергия U выражается в КДж/моль. Внутренняя энергия складывается из потенциальной и кинетической энергии частиц, образующих данное вещество или систему. U = E кин + E потен

Приведенное уравнение выражает закон сохранения энергии.
При изобарном процессе р = const А = р ( V 2 – V 1 ). Тогда математическое выражение для теплового эффекта химической реакции примет вид:
Где Н2 – энтальпия системы в конечном состоянии
Н1 – энтальпия системы в начальном состоянии
тогда ∆Н – изменение энтальпии.
Т.о. энтальпия – это термодинамическая величина, определяющая энергию необходимую для перевода системы из одного состояния в другое и учитывающая изменение внутренней энергии и совершаемую работу. Энтальпия, как и все термодинамические величины, является функцией состояния, т.к. ее изменение определяется только начальным и конечным состоянием системы и не зависит от путей перехода.

Для экзотермических реакций ∆Н 0, для эндотермических ∆Н > 0, Q
Для сравнения термодинамических величин различных процессов изменение Н и U относят к стандартным условиям (Т = 298 0 К, Р = 101,3 КПа). Изменение энтальпии при образовании в стандартных условиях 1 моля химического соединения из устойчивых простых веществ называется стандартной энтальпией образования ∆Н 0 298 КДж/моль. Энтальпии образования устойчивых простых веществ (Н2, О3, Са) условно приняты равными 0.
Термохимические расчеты осуществляются на основании закона Гесса и 2-х следствий из него.
Закон Гесса: Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от числа и характера промежуточных стадий.
Классическая термодинамика изучает обратимые процессы, отсюда
2-е следствие: Изменение энтальпии химической реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Для реакции общего вида
А, B – исходные вещества,
С, D – продукты реакции,
математическое выражение 2-е следствия из закона Гесса будет иметь вид:
∆Н х.р. = (с ∆Н 0 298С + d ∆Н 0 298 D ) – (а ∆Н 0 298А + b ∆Н 0 298 B )
Можно было бы предположить, что самопроизвольно протекают только те реакции, в которых энтальпия системы уменьшается. Однако известны экзотермические реакции, не протекающие при высоких температурах и эндотермические реакции, происходящие при небольших температурах. Следовательно, возможность самопроизвольного протекания процесса определяется не только изменением энтальпии, но и другой термодинамической величиной, которая называется энтропией.
Энтропия S (Дж /моль К) характеризует стремление системы перейти из более упорядоченного состояния в менее упорядоченное состояние и является количественной характеристикой степени неупорядоченности системы.
В отличие от энтальпии энтропия простых веществ не равна 0; ее абсолютные значения можно определить экспериментально; энтропия зависит от температуры.
Т.о. система самопроизвольно может переходить в термодинамически более устойчивое состояние 2-мя способами:
1 – уменьшением энтальпии (количественно характеризуется энтальпийным фактором ∆Н),
2 – увеличением энтропии (количественно характеризуется энтропийным фактором Т∆ S ).
Энергия Гиббса зависит от природы веществ, их количества и температуры. Абсолютную величину энергии Гиббса определить нельзя, но можно определить ее изменение в каком либо процессе, т.е. ∆G является функцией состояния, и к ней применимо второе следствие из закона Гесса. Для сравнения ∆G различных процессов, ∆G приводят к стандартным условиям.
Стандартные энергии Гиббса простых веществ принимаются равными 0.
Характер изменения стандартной ∆G 0 298 при химических реакциях позволяет судить о возможности протекания процесса в прямом или обратном направлении.
При ∆G = 0 система находится в состоянии термодинамического равновесия
При ∆G > 0 процесс самопроизвольно протекает в обратном направлении
Т.о. условием самопроизвольного протекания процесса является уменьшение ∆G системы.
Зависимость направленности процессов от соотношения ∆Н и Т∆ S
При низких температурах Т∆ S принимает небольшие значения Þ при условии ∆Н > Т∆ S самопроизвольно могут протекать экзотермические реакции.
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА, рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают. Анализ тепловых явлений базируется на трех фундаментальных принципах, подтвержденных данными многочисленных наблюдений. См. также ТЕРМОДИНАМИКА.
Первое начало термодинамики.
Первое начало термодинамики по существу выражает закон сохранения энергии. Для системы, окруженной замкнутой границей, через которую не происходит переноса вещества, справедливо соотношение
где U1 и U2 – энергии системы в состояниях 1 и 2; Q – теплота, полученная от внешних источников; W – работа, совершенная системой над внешними телами в процессе, посредством которого система переходит из состояния 1 в состояние 2. Если процесс – химическая реакция, то обычно ее проводят в таких условиях, чтобы можно было отделить энергию химического превращения от энергии, связанной с одновременными изменениями температуры или давления. Поэтому энергию (теплоту) химической реакции обычно определяют в условиях, в которых продукты находятся при тех же температуре и давлении, что и реагенты. Энергия химической реакции тогда определяется теплотой Q, полученной от окружающей cреды или переданной ей. Измерение Q может быть проведено с помощью калориметра подходящего типа. Реакцию можно было бы провести, например, в металлическом сосуде, погруженном в теплоизолированный объем воды, изменение температуры которой (обычно на несколько градусов) соответствует теплоте реакции. Для количественных измерений калориметр обычно градуируют с помощью независимого электронагревателя или проведения в сосуде химической реакции, теплота которой известна.
Медленные реакции особенно трудны для калориметрических измерений, поскольку нужны сложные меры предосторожности для защиты калориметра от теплообмена с окружающей средой. Так называемый адиабатический калориметр целиком погружается в изотермическую оболочку с независимым нагревом, температура которой во время опыта поддерживается как можно более близкой к температуре внутри калориметра. Реакции, высвобождающие теплоту (отрицательная Q в уравнении (1)), называются экзотермическими, а реакции, в процессе которых теплота поглощается, – эндотермическими.
Вводят вспомогательную меру энергии системы Н, определяемую общим соотношением
Если давление постоянно (обычно в качестве стандартного берется давление 1 атм), то изменение функции Н, называемой энтальпией системы, отличается от изменения ее внутренней энергии на величину работы расширения:
Этот вывод был сделан Г.И.Гессом в 1840 на основе экспериментальных фактов еще до классических опытов Джоуля, продемонстрировавших эквивалентность теплоты и других форм энергии. Гесс показал, что теплота реакции, протекающей через несколько последовательных стадий, равна алгебраической сумме теплот отдельных промежуточных реакций. Закон Гесса, как отметил Г.Гельмгольц в 1847, служит прямым экспериментальным подтверждением применимости закона сохранения энергии к энергетике химических реакций. В пределах ограничений, налагаемых уравнением (5), этот закон был многократно подтвержден многочисленными дальнейшими исследованиями.
Термохимические уравнения.
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом D H ° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25 ° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница между D H ° и D U ° равна – 1,183 ккал и представляет работу p (V2 – V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды.
Стандартная теплота образования.
Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества. Теплота образования может быть определена различными способами, в том числе прямыми калориметрическими измерениями и путем косвенного расчета (на основе закона Гесса) из теплоты реакции, в которой участвует данное вещество. При проведении расчетов пользуются стандартными (при p = 1 атм и T = 298 K) теплотами образования веществ, входящих в уравнение реакции. Например, стандартную теплоту (энтальпию) образования метана можно вычислить с помощью термохимического уравнения
Хотя эта реакция практически неосуществима при 25 ° С, стандартная теплота образования метана косвенно рассчитывается по измеренным теплотам сгорания метана, водорода и графита. На основе закона Гесса устанавливается, что теплота реакции равна разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых с соответствующими знаками и стехиометрическими коэффициентами).
Помимо использования термохимических данных для решения проблем практического использования тепловой энергии, они широко применяются при теоретической оценке энергий химических связей. Этот вопрос подробно рассмотрен Л.Полингом в книге Природа химической связи (The Nature of the Chemical Bond, 1960).
Второе начало термодинамики.
Второе начало термодинамики по существу определяет однонаправленность переноса теплоты в разнообразных процессах, происходящих спонтанно при определенных условиях, а именно – направление переноса теплоты от тел с высокой температурой к телам с низкой температурой. Второе начало термодинамики может быть сформулировано следующим образом: не может быть спонтанного общего переноса теплоты от тел менее нагретых к телам более нагретым.
где S2 – S1 – разность энтропий системы в двух состояниях. Если скомбинировать это условие с уравнениями (2) и (3), получим соотношение, имеющее важное значение для описания химической реакции при постоянных температуре и давлении:
Если ввести функцию состояния системы
то формулировка второго начала термодинамики примет следующую форму:
Это значит, что для системы, находящейся при постоянных температуре и давлении, могут происходить только такие переходы из одного состояния в другое, для которых полезная работа We не превышает определенной максимальной величины, равной разности D G двух значений G. Если G1 > G2, то переход из состояния 1 в состояние 2 (скажем, от реагентов к продуктам) может происходить самопроизвольно даже при We = 0. Если G2 > G1, то переход из состояния 1 в состояние 2 может быть осуществлен только за счет внешней полезной работы; это значит, что работа We должна быть отрицательной величиной, как, например, электрическая энергия, затрачиваемая при электролитическом разложении воды. Если G1 = G2, то система находится в равновесии.
Стандартная гиббсова энергия химической реакции по существу является мерой того, насколько реагенты и продукты далеки от равновесия друг с другом при данной температуре и стандартном давлении 1 атм. Согласно второму началу термодинамики, все самопроизвольные изменения системы и ее окружения стремятся привести их в конечное состояние равновесия. Следовательно, именно изменение гиббсовой энергии, а не изменение энтальпии или внутренней энергии определяет возможность протекания химической реакции. В частности, от изменения гиббсовой энергии в ходе химической реакции зависит разность потенциалов между электродами химических источников тока.
Стандартное изменение гиббсовой энергии связано со стандартным изменением энтальпии, согласно (7), соотношением
Можно показать, что функциональная связь между D G ° для данной химической реакции и константой равновесия К, определяемой законом действующих масс, имеет вид
Таким образом, константа равновесия состоит из двух множителей, один из которых содержит энтальпию реакции (или, при определенных условиях, внутреннюю энергию реакции), а другой – энтропию.
Третье начало термодинамики.
Еще один важный принцип химической термодинамики был установлен в первой четверти 20 в. В.Нернстом. Он экспериментально установил, что, когда температура приближается к абсолютному нулю, стандартные энтропии D S ° для многих химических реакций стремятся к нулю. Поскольку этот результат не следует из первого и второго начал термодинамики, он получил название третьего начала термодинамики. Оно не имеет столь же общего характера, как первые два начала, однако большинство очевидных исключений или аномалий получило удовлетворительное объяснение с учетом особенностей кристаллического строения конкретных веществ.
Значение принципа Нернста состоит в том, что зависимость энтропии реакции от температуры может быть выведена, согласно термодинамической теории, исключительно из данных по теплоемкости для отдельных участвующих в реакции веществ. Это значит, что, если известно значение D S ° при какой-либо одной температуре (при T = 0 D S ° = 0), значения энтропии реакции при других температурах вычисляются исключительно из тепловых измерений. Аналогично этому, величина D H ° может быть получена из калориметрических данных путем непосредственного измерения теплоты данной реакции либо косвенно, путем измерения теплот других реакций и применения закона Гесса. Следовательно, подстановка полученных значений D H ° и D S ° в уравнение (9) или (11) дает гиббсову энергию или константу химического равновесия исключительно из тепловых измерений. Это позволяет предвидеть направление и равновесное состояние химической реакции еще до того, как найден способ ее проведения.
Для практического применения третьего начала термодинамики требуются точные результаты измерений теплоемкости вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4 К). Это направление термодинамических исследований химических явлений стимулировали криогенные исследования, выполненные в последние десятилетия. См. также ФИЗИКА НИЗКИХ ТЕМПЕРАТУР.
Исаев С.И. Курс химической термодинамики. М., 1975
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М., 1975
Еремин Е.Н. Основы химической термодинамики. М., 1978
Термодинамика и кинетика химических процессов. Л., 1981
Глазов В.М., Павлова Л.М. Химическая термодинамика и фазовые равновесия. М., 1988
Химическая термодинамика
Определение и общие понятия химической термодинамики
Термодинамика является макроскопической теорией.
Химическая термодинамики использует термодинамические методы для решения задач химии, например, исследования теории разных видов химических и фазовых равновесий и свойств веществ в растворах.
Основной физической величиной, которая подлежит рассмотрению в термодинамике, является энергия. Основным законом термодинамики является вариация закона сохранения энергии. Спецификой макроскопических систем, рассматриваемых в термодинамике, является то, нельзя провести непосредственное измерение энергии макроскопической системы. Разные методы в физике дают возможность определить изменение энергии отдельных частиц системы (атомов, молекул, ионов). Не существует способов прямого измерения энергии как единого целого. Изменение энергии макросистемы определяют как теплоту или работу. Существование внутренней энергии макросистемы (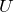
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя которые описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул.
На основе первого начала термодинамики составляют уравнения теплового баланса. Второе и третье начала термодинамики служат для анализа фазового и химического равновесия.
Задачи химической термодинамики
Исследование законов химического и физического равновесия дают возможность решать следующие основные задачи:
Основные законы химической термодинамики
Первый закон термодинамики, которой отображает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это одни из видов законов сохранения энергии. Формулировок первого начала термодинамики несколько, запишем один из них для закрытой системы:
где 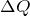
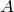
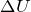
Энтальпией (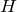
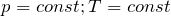
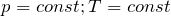
Закон Гесса для химических реакций говорит о том, что: величина теплового эффекта изобарных или изохорных процессов зависит только от начального и конечного состояний системы и не зависит от хода процесса.
Закон Гесса применяют для вычисления тепловых эффектов химических реакций.
Закон Гесса имеет полезные следствия:
Второй закон термодинамики говорит о направлении протекания процессов. Все самопроизвольные процессы происходят так, что система стремится к минимуму энергии, при этом энтропия системы увеличивается.
Примеры решения задач
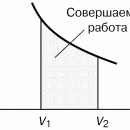
| Задание | Каково затраченное количество теплоты в процессе, изображенном на рис.1? Процесс проводят с 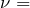 1 молем азота. Масса газа в процессе не изменяется. 1 молем азота. Масса газа в процессе не изменяется. |
где 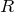
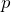
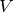
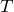
На рис. 1 изображен изобарический процесс. Для этого процесса запишем первое начало термодинамики в интегральном виде:
где изменение внутренней энергии газа можно найти как:
Работа при изобарном процессе в идеальном газе может быть найдена как:
Из уравнения (1.1) и того, что 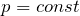
Используя (1.2),(1.3) и (1.5) получаем:
Для азота будем считать 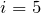
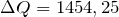 Дж
Дж| Задание | Вычислите изменение энтальпии (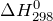 ) для химической реакции: ) для химической реакции: 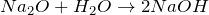 , используя стандартные теплоты образования веществ. Каков тип реакции? , используя стандартные теплоты образования веществ. Каков тип реакции? |
| Решение | Отметим, что 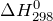 индекс 0 обозначает стандартное давление равное одной атмосфере; 298 – это температура индекс 0 обозначает стандартное давление равное одной атмосфере; 298 – это температура 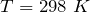 , которая считается стандартной температурой протекания химических реакций. , которая считается стандартной температурой протекания химических реакций. |
Из справочных материалов возьмем значения стандартных энтальпий образования веществ 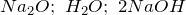
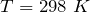
Используя следствие закона Гесса имеем: