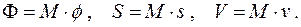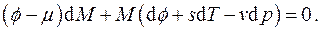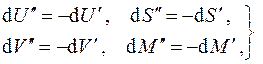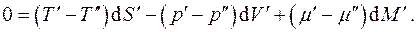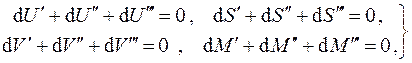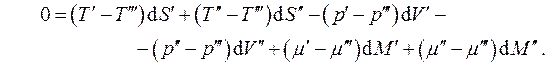ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
-термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа частиц в системе и необходимая для описания свойств открытых систем (с перем. числом частиц).
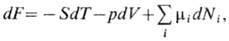
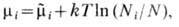
где 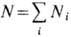
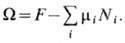
полное число частиц в системе не фиксировано, а должно определяться из условия термодинамич. равновесия, как, напр., для фононов в твёрдом теле или для фотонов в случае равновесного теплового излучения, то равновесие характеризуется равенством нулю X. п.
Понятие X. п. позволяет сформулировать условия равновесия термодинамического. Одно из условий состоит в том, что X. п. любого компонента одинаков в разл. фазах и в разных местах одной фазы. Это обусловлено возможностью перераспределения частиц, приводящего к выравниванию X. п. Для систем в пространственно неоднородном внеш. поле равновесие означает, что
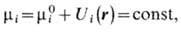
X. п. был введён Дж. У. Гиббсом (J. W. Gibbs) в 1875 при рассмотрении хим. равновесия в многокомпонентных системах, отсюда его название. Численно X. п. выражается в единицах энергии на единицу массы (Дж/кг), или на единицу кол-ва вещества (Дж/моль), или на 1 частицу.
Лит. см. при ст. Термодинамика. А. Э. Мейерович.
Химический потенциал
Полезное
Смотреть что такое «Химический потенциал» в других словарях:
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ — термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа ч ц в системе и необходимая для описания св в открытых систем (с перем. числом ч ц). X. п. mi i го компонента многокомпонентной системы… … Физическая энциклопедия
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ — понятие, используемое для описания термодинамического равновесия в многокомпонентных системах. Обычно химический потенциал компонента системы вычисляют как частную производную гиббсовой энергии по числу частиц (или молей) этого компонента при… … Большой Энциклопедический словарь
химический потенциал — – парциальная молярная энергия Гиббса вещества. Химический потенциал данного вещества отражает изменение энергии Гиббса при добавлении 1 моля этого вещества в изучаемую систему. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
химический потенциал — Гиббса … Cловарь химических синонимов I
химический потенциал — Частная производная от характеристической функции по массе компонента при постоянных соответствующих независимых параметрах и массах остальных компонентов. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет… … Справочник технического переводчика
химический потенциал — [chemical potential] термодинамическая функция, применяемая при описании состояний систем с переменный числом компонентов. В системе из i компонентов химический потенциал определяется как приращение ее внутренней энергии при добавлени бесконечно… … Энциклопедический словарь по металлургии
химический потенциал — понятие, используемое для описания термодинамического равновесия в многокомпонентных и (или) многофазных системах. Обычно химический потенциал компонента системы вычисляют как частную производную энергии Гиббса по числу частиц (или молей) этого… … Энциклопедический словарь
Химический потенциал — У этого термина существуют и другие значения, см. Потенциал. Термодинамические величины … Википедия
химический потенциал — cheminis potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Bendrąja prasme – intensyvusis dydis. Tai termodinaminė jėga μ, apibūdinanti sistemos pusiausviruosius ir nepusiausviruosius medžiagos mainus: medžiaga visada… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
химический потенциал — cheminis potencialas statusas T sritis chemija apibrėžtis Intensyvusis dydis, apibūdinantis fizikocheminius termodinaminės sistemos virsmus ir pusiausvyrą. atitikmenys: angl. chemical potential rus. химический потенциал … Chemijos terminų aiškinamasis žodynas
химический потенциал — cheminis potencialas statusas T sritis fizika atitikmenys: angl. chemical potential vok. chemisches Potential, n rus. химический потенциал, m pranc. potentiel chimique, m … Fizikos terminų žodynas
Химический потенциал
Хим и ческий потенци а л ( m i), термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, химический потенциал определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме V, энтропии S и количествах молей каждого из остальных компонентов nj (j ¹ i). В общем случае химический потенциал может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G — при постоянных давлении р, температуре Т и nj; гельмгольцевой энергии А — при постоянных V, Т и nj; энтальпии Н — при постоянных S, р и nj. Таким образом:
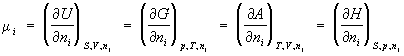
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеальных газов — m i зависит лишь от концентрации рассматриваемого компонента и от температуры:
где pi — парциальное давление компонента i в смеси, R — газовая постоянная, m i 0 — значение m i при pi = 1 атм. Для смеси неидеальных газов в равенстве (2) должна стоять фугитивность этого компонента. Химический потенциал характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации, химического взаимодействия и т.д.). В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу, для которой его химический потенциал меньше. Такой переход сопровождается уменьшением химического потенциала этого компонента в 1-й фазе и увеличением во 2-й. В результате разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и при достижении равновесия химический потенциал компонента становится одинаковым в обеих фазах. В любой равновесной гетерогенной системе химический потенциал каждого компонента одинаков во всех фазах.
Если в различных фазах или в разных местах одной фазы химический потенциал какого-либо компонента неодинаков, то в системе самопроизвольно (без затраты энергии извне) происходит перераспределение частиц, сопровождающееся выравниванием химического потенциала.
Из условий термодинамического равновесия систем, в которых возможны химические реакции, фазовые переходы и др. процессы перераспределения частиц, и уравнения, учитывающего баланс частиц, вытекают важнейшие термодинамические соотношения: действующих масс закон, фаз правило Дж. У. Гиббса, основные законы разбавленных растворов (см. Вант-Гоффа закон, Рауля законы, Генри закон и др.) и т.д.
Химический потенциал в качестве нормировочной постоянной входит в распределение Больцмана, а также в распределения по энергиям Бозе — Эйнштейна и Ферми — Дирака для частиц идеального газа (см. Статистическая физика). Химический потенциал вырожденного газа электронов (ферми-газа) тождественно совпадает с граничной ферми энергией.
Химический потенциал был введён Гиббсом, численно выражается в единицах энергии на единицу количества вещества (дж/моль) или на единицу массы (дж/кг).
Лит. см. при статьях Термодинамика, Статистическая физика.
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ
-термодинамич. функция состояния, определяющая изменение потенциалов термодинамических при изменении числа частиц в системе и необходимая для описания свойств открытых систем (с перем. числом частиц).
компонента. Часто величины mi удобно использовать в качестве независимых термодинамич. переменных вместо Ni. В переменных Т, V,mi состояние системы характеризует термодинамич. потенциал
полное число частиц в системе не фиксировано, а должно определяться из условия термодинамич. равновесия, как, напр., для фононов в твёрдом теле или для фотонов в случае равновесного теплового излучения, то равновесие характеризуется равенством нулю X. п.
Понятие X. п. позволяет сформулировать условия равновесия термодинамического. Одно из условий состоит в том, что X. п. любого компонента одинаков в разл. фазах и в разных местах одной фазы. Это обусловлено возможностью перераспределения частиц, приводящего к выравниванию X. п. Для систем в пространственно неоднородном внеш. поле равновесие означает, что
X. п. был введён Дж. У. Гиббсом (J. W. Gibbs) в 1875 при рассмотрении хим. равновесия в многокомпонентных системах, отсюда его название. Численно X. п. выражается в единицах энергии на единицу массы (Дж/кг), или на единицу кол-ва вещества (Дж/моль), или на 1 частицу.
Лит. см. при ст. Термодинамика. А. Э. Мейерович.
Химический потенциал



Термодинамика фазовых переходов. Определения
Рассмотрим термодинамику систем, в которых могут иметь место фазовые переходы. Термодинамическая система, которая может обмениваться веществом с окружающей средой, называется открытой.
— Термодинамическая система называется однородной или гомогенной, если в каждой малой её части физические свойства вещества и интенсивные термодинамические параметры одинаковы или меняются в пространстве непрерывным образом.
— Термодинамические системы, в которых физические свойства вещества и интенсивные параметры меняются скачкообразно на некоторых поверхностях внутри системы, называются гетерогенными. Примером гетерогенной системы является кипящая жидкость.
— Области в гетерогенной системе с однородными или непрерывно изменяющимися свойствами и параметрами называются фазами. При равновесии гетерогенной системы в отсутствие внешних полей интенсивные параметры в пределах каждой фазы постоянны.
Но в различных фазах эти интенсивные параметры не обязаны быть одинаковыми. Гомогенная система является, таким образом, однофазной.
— Каждая из фаз в общем случае может представлять собой гомогенную смесь химически чистых веществ, между которыми возможны химические реакции. Химически чистые вещества в смеси называются компонентами. Фазы в общем случае могут обмениваться не только энергией в форме работы или теплоты, но и веществом. Превращение вещества из одного фазового состояния в другое называется фазовым переходом.
Пусть однокомпонентная однофазная ТД система является открытой, причём только вещество, составляющее систему, может проникать через оболочку. И пусть система является равновесной.
Изменение внутренней энергии такой системы будет происходить не только вследствие подвода теплоты и совершения над ней работы, но также и вследствие изменения её массы. Вещество, проникающее через оболочку, несёт присущую ему энергию. Тогда уравнения Гиббса для каждого из четырёх термодинамических потенциалов (5.3) и (5.5) следует дополнить ещё одним слагаемым, пропорциональным изменению массы системы, т.е.
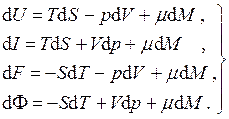
Величина μ, определяемая частными производными
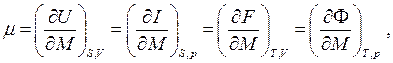
носит название химического потенциалаи имеет смысл изменения энергии термодинамической системы при изменении её массы на единицу при поддержании постоянной той или иной пары независимых параметров системы.
Найдём связь химического потенциала с другими потенциалами системы. Для этого рассмотрим в (4.12) четвёртое из выражений. Свободную энергию Гиббса Φ, энтропию S и объём системы V запишем через их удельные величины:
Заменяя дифференциал свободной энергии Гиббса его выражением 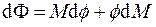
Согласно (4.5) для M = const = 1 кг 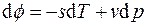
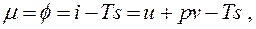
т.е. химический потенциал вещества есть его удельная свободная энергия Гиббса.
4.6. Условия термодинамического равновесия многофазных систем. Правило фаз Гиббса
Рассмотрим однокомпонентную систему, состоящую из двух взаимодействующих фаз. Пусть каждая из фаз находится в своём внутреннем равновесии, т.е. каждая из них характеризуется своим набором параметров. Изучим вопрос о равновесии между фазами. Для этого заключим всю систему в изолирующую оболочку (рис.4.1). Тогда при малом изменении состояния каждой из фаз (подсистем) можно записать для них термодинамические тождества в соответствии с (4.1)
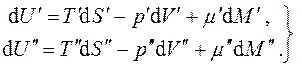
В силу аддитивности экстенсивных величин 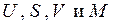
т.е. после суммирования равенств (4.5) получаем:
В силу произвольности дифференциалов 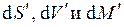
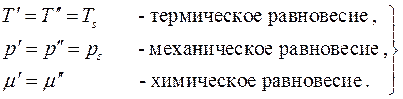
Химический потенциал по определению сам является функцией естественной пары переменных 
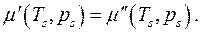
Вид функций 

Рассмотрим равновесие трёхфазной однокомпонентной системы. В данном случае:
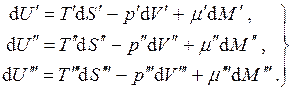
Но для замкнутой системы:
с учётом чего, складывая уравнения (4.8), получаем:
Так как все дифференциалы здесь независимы и значения их произвольны, находим условия равновесия:
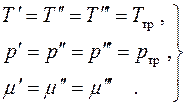
Химическое равновесие, т.е. равенство химических потенциалов фаз, может быть записано в виде двух алгебраических уравнений
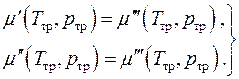
Это есть система двух уравнений с двумя неизвестными 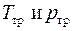
Для равновесной четырёхфазной однокомпонентной системы:
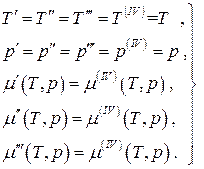
систему трёх уравнений с двумя неизвестными. Такая система уравнений является несовместной за исключением случая, когда любые два из них пропорциональны друг другу, т.е. когда две из четырёх фаз фактически неразличимы, а это уже будет трёхфазная система. Таким образом, в равновесной однокомпонентной системе возможно одновременное сосуществование не более, чем трёх фаз. Если равновесная термодинамическая система является многокомпонентной, то число одновременно сосуществующих фаз может быть больше трёх, а именно
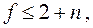
где n есть число компонентов системы. Этот результат носит название правила фаз Гиббса.
1. Организационная часть лекции: принимается рапорт о готовности курсантов к занятию, отмечаются в журнале отсутствующие (время 3-5 мин.).
2. Введение к разделу «Тепломассообмен».
· Основной закон теплопроводности.
· Дифференциальное уравнение теплопроводности.
К следующему занятию курсанты должны:
ЗНАТЬ: дифференциальное уравнение теплопроводности; определения коэффициентов тепло- и температуропроводности.
УМЕТЬ: применять краевые условия при решении задач на уравнение Фурье.
ИМЕТЬ ПРЕДСТАВЛЕНИЕ: о механизмах переноса тепла в телах различного строения и агрегатного состояния.
4. Задания на самоподготовку:
_____________/ профессор каф. физики и теплообмена, д.ф.-м.н., П.В. Скрипов
Лекция рассмотрена и одобрена на заседании кафедры
Протокол №_______ от «_____»_____________ 2011 г.
Заведующий кафедрой физики и теплообмена
профессор, д.т.н. __________________ / Н.М. Барбин