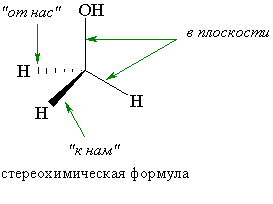
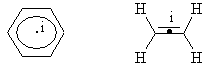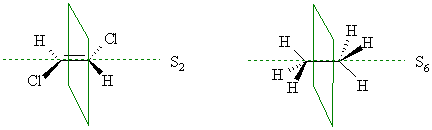Что такое хиральные молекулы
Энантиомерия – явление существования энантиомеров (оптических антиподов), соединений, относящихся друг к другу как предмет и его зеркальное отражение. Энантиомеры существуют не только для истинно асимметричных молекул (т.е. молекул, лишенных любых элементов симметрии), но и в случае хиральных молекул. Что же такое хиральность и чем она отличается от асимметрии?
Молекула симметрична, если при перестановке в ней местами атомов или атомных групп не происходит никаких изменений ее структуры. Перестанавливаемые части молекулы по симметрии эквивалентны, они неразличимы, хотя и не идентичны. Их перестановка возможна с помощью операций симметрии, которые, в свою очередь, могут быть проведены с элементами симметрии. На основе свойств симметрии становится возможной четкая классификация стереоизомеров.
Элементы симметрии представляют собой геометрические места в структуре молекулы, относительно которых осуществляются операции симметрии – вращение, отражение, инверсия и вращение с отражением.
Элементы симметрии делятся на два вида. Элементы симметрии 1 рода – оси симметрии (оси вращения, символ «Сn»).
Элементы симметрии 2 рода – плоскости симметрии (зеркальные плоскости, символ « σ »), центры симметрии (центры инверсии, символ «i»), оси зеркального отражения (символ «Sn»).
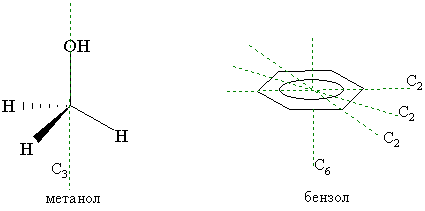
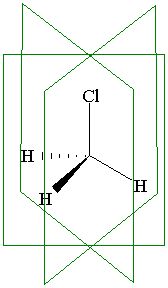
Ось симметрии. Если вращение молекулы вокруг какой-либо проходящей через нее оси на угол 360°/n приводит к структуре, не отличающейся от исходной, то такую ось называют осью симметрии n-го порядка Сn. Понятно, что условию n=1 удовлетворяет любая молекула, так как при этом она вращается на 360°. Так, молекула метанола имеет ось симметрии третьего порядка С3 в направлении связи С – ОН. В бензоле наряду с шестью осями С2, лежащими в плоскости молекулы и проходящими через центр симметрии, имеется еще ось С6, также проходящая через центр симметрии, но перпендикулярная к плоскости кольца. Чем выше порядок оси симметрии (n), тем выше симметричность молекулы.
Все плоские молекулы имеют, по крайней мере, одну плоскость симметрии – плоскость молекулы. Линейные же молекулы содержат бесконечное множество плоскостей симметрии.
Центр симметрии – это точка в молекуле, относительно которой на прямой, проходящей через нее, тождественные заместители находятся на одинаковом расстоянии (i). В молекуле не может быть более одного центра симметрии. Так, центры симметрии имеют молекулы этилена и бензола.
Ось зеркального отражения. Если комбинация вращения вокруг какой-либо проходящей через молекулу оси на угол 360°/n и последующего зеркального отражения каждого из атомов в плоскости, перпендикулярной к этой оси, приводит к эквивалентной ориентации, то такая ось носит название оси зеркального отражения n-го порядка. Так, в транс-1,2-дихлорэтене имеется ось зеркального вращения второго порядка S2, а заторможенная конформация этана содержит ось зеркального отражения шестого порядка S6:
Молекулы, которые содержат элементы симметрии II рода, обладают симметрией отражения и называются ахиральными или недиссимметричными.
Любой предмет, имеющий плоскость, центр или зеркально-поворотную ось симметрии можно совместить с его зеркальным отображением. Т.е. такие молекулы будут ахиральны, т.е. лишенные хиральности. Если молекулы не имеют элементов симметрии или имеют только поворотные оси симметрии, то их нельзя совместить с их зеркальным отображением, следовательно, они являются хиральными. При этом асимметричные молекулы – те, что лишены любых элементов симметрии.
Хиральность (рукоподобие, от греч. cheir – рука) заключается в парности существования молекул, являющихся друг по отношению к другу предметом и несовместимым с ним его зеркальным отображением. Это явление характерно и для некоторых материальных объектов, например, левая и правая рука, право- и левозакрученная спирали (винты, болты с левой и правой нарезкой), модификации кристаллов и т. д. Общим критерием, присущим всем хиральным объектам, является отсутствие элементов симметрии II рода.
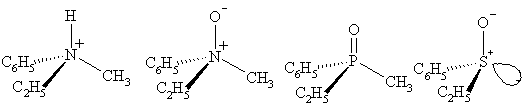
Существуют и неуглеродные хиральные центры. Такая точечная хиральность встречается, например, в четвертичных аммониевых солях и N-оксидах (хиральный атом азота), фосфиноксидах (хиральный атом фосфора), сульфоксидах (хиральный атом серы).
Следует подчеркнуть, что все асимметрические молекулы хиральны, но, с другой стороны, не все хиральные молекулы асимметричны.
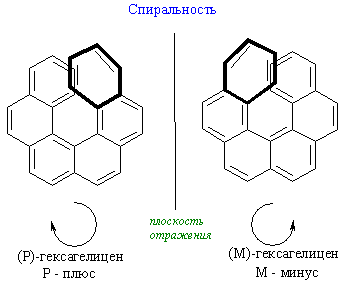
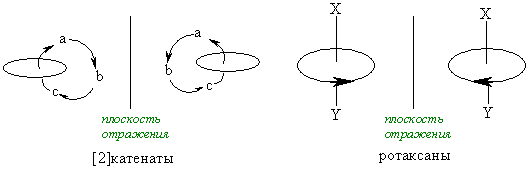
Состояние молекулярной асимметрии не ограничивается только молекулами, содержащими асимметрические центры; асимметричными в целом способны быть и атомные ансамбли, не содержащие асимметрического центра. В качестве примера таких соединений можно привести замещенные аллены и бифенилы, проявляющие аксиальную хиральность; замещенные ферроцены, имеющие планарную хиральность; гексагелицен, катенаты и ротаксаны – как представители соединений, обладающих спиральностью. Спиральность – представляет собой особый вид хиральности, наиболее характерный для биополимеров (полисахаридов, белков, нуклеиновых кислот). Спираль всегда хиральна, так как помимо винтовой оси и шага она характеризуется также и типом винтообразного движения (по или против часовой стрелки – право- и левозакрученные спирали). Это более высокий уровень хиральности.
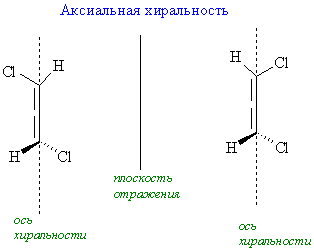
Хиральные объекты могут обладать поворотными осями симметрии. К их числу относятся молекулы, имеющие одну ось симметрии (С2 или С3), которые могут быть совмещены сами с собой после поворота на 180°, однако остаются не совмещаемыми после отражения в зеркальной плоскости (поэтому они и хиральны):
Загадка природы: как физики используют хиральность и зачем это нужно фармакологии
В этом году специалисты Лаборатории моделирования и дизайна наноструктур Университета ИТМО опубликовали несколько статей о хиральности нанокристаллов в таких топовых зарубежных журналах как Optics Letters, Journal of Applied Physics и Scientific Reports. Работа, посвященная оптической активности нанокристаллов хиральных форм, была высоко оценена Американским оптическим обществом и попала в центр внимания редакции Optics Letters. А ведь большинство людей и не задумывается о необычном свойстве хиральности, которое исследуют ученые, хотя оно существенно влияет на нашу жизнь. Почему же хиральность нанокристаллов и биомолекул столь важна для нас? Какие методы разрабатывают специалисты, чтобы отделить опасные вещества от полезных? Об этом рассказали руководитель Лаборатории моделирования и дизайна наноструктур Иван Рухленко и сотрудник подразделения Никита Тепляков.
Необъяснимое свойство жизни
«Хиральных объектов, которые не совмещаются со своим зеркальным отражением, вокруг нас очень много: как микроскопических — различных органических и неорганических молекул, так и макроскопических — например, спиральных галактик. Раковины морских моллюсков вроде наутилуса, человеческая ладонь или ступня, обычный шуруп — все они обладают хиральностью. Таким образом, хиральность широко распространена как среди живых организмов, так и среди объектов неживой природы», — объясняет руководитель лаборатории Иван Рухленко.
По словам ученого, пространственные формы молекул бывают «левыми» и «правыми». Поскольку биомолекулы хиральны, их взаимодействие с организмами существенно зависит от их формы — правой или левой. Это важно, поскольку в настоящее время сотни препаратов, которые применяются в фармакологии, являются энантиомерами. Два отражения одного энантиомера могут обладать совершенно разными свойствами: например, левое вещество может оказывать положительный эффект при лечении заболевания, а его отражение, наоборот, может быть смертоносным. Так, например, в 60-е годы препарат талидомид прописывали беременным женщинам при токсикозе. И ученые на тот момент не придали значения тому, что талидомид обладает энантиоморфизмом: одна его молекула спасала от утренней тошноты, а другая, которая оказалась в лекарстве, приводила к уродству новорожденных. Именно поэтому очень важно разделять энантиомеры и исследовать их свойства по отдельности. После их разделения и описания их патентуют как разные вещества. А как же разделить молекулярные смеси разных энантиомеров?

Разделить и не спутать
Лекарственные молекулы отделить друг от друга очень сложно. Ведь энантиомеры обладают абсолютно одинаковыми химическими и физическими параметрами — температурой плавления и испарения, плотностью. Все привычные методы разделения для них не работают. Так что единственный способ их как-то разделить — использовать для этого другие хиральные объекты. Смесь энантиомеров с пропорцией 1:1 называется рацемической смесью, и хиральными свойствами не обладает. Если же она химически прореагирует с каким-то хиральным соединением — гомохиральной молекулой, то получившиеся вещества станут диастереомерами. Они, в свою очередь, не будут зеркальным отражением друг друга, и уже не будут обладать разными температурой плавления, температурой кипения или плотностью. Разделять их после этого можно с помощью, например, центрифугирования. Однако изначально нужно конвертировать вещество путем химической реакции во что-то, а затем восстановить. Причем последовательность химических реакций уникальна для каждого отдельного вещества.
Так, например, есть способ хиральной хроматографии. Для этого используется некая стационарная фаза — силикагель, приготовленный с помощью хиральных сахаров. Через вертикальную колонку с силикагелем прогоняется рацемическая смесь, и одна из фаз смеси левых и правых энантиомеров задерживается. То есть сначала выходит одна обогащенная фаза, а затем другая. Однако такой способ — настоящее искусство, отмечает Иван Рухленко.
«Подобрать к веществу конкретную стационарную фазу крайне сложно. Это трудоемкий метод проб и ошибок. К установленной фазе нужно подобрать специальные условия, в которых разделение вещества окажется успешным. Кроме того, метод работает лишь в аналитическом масштабе, а в промышленности применяться уже не может. Ведь там все лекарства должны быть безупречно энантиомерно чистыми — на кону жизни людей. Есть и другая проблема: часто на выходе тяжело определить, какой же из разделенных энантиомеров является безопасным», — поясняет ученый.
Нанокристальная помощь
Самым простым классическим хиральным объектом в оптике является циркулярно поляризованный свет, закрученный по спирали. Однако молекулы плохо взаимодействуют со светом. Казалось бы, силой оптического давления разные молекулы одного энантиомера можно было бы легко разделить, но, увы, молекулы намного меньше длины волны света, который они поглощают, и в них мало атомов. Да и броуновское движение перемешивает молекулы быстрее, чем способен их разделить свет. Однако разделением одних молекул дело не заканчивается. Люди научились создавать полупроводниковые нанокристаллы, которые тоже оказываются хиральными. Вместе с тем, создавать нанокристаллы идеальной формы трудно — чаще всего они обладают изъянами. Например, у них может отсутствовать уголок или присутствовать лишний атомарный «нарост». И такие объекты уже не будут обладать зеркальной симметрией. Поскольку количество атомов в хиральных нанокристаллах намного больше, чем в молекулах, их взаимодействие со светом будет сильнее. Поэтому они могут использоваться в будущем для разделения энантиомеров лекарственных хиральных молекул и их идентификации в сенсорах. Это важно, например, когда нужно быстро отличить лекарственную подделку на таможне.
«Как можно использовать нанокристаллы в сенсорах и для разделения энантиомеров? Во-первых, если светом или каким-либо другим способом разделить сами нанокристаллы, то потом к ним можно будет селективно присоединить хиральные молекулы. После этого, отделив свободные молекулы от молекул с нанокристаллами светом или магнитным полем, можно разделить саму рацемическую смесь. Дальше можно очистить молекулы от нанокристаллов, а сами нанокристаллы еще не раз использовать по новой, добиваясь большей чистоты смеси. Что касается сенсоров, тут даже проще: стоит капнуть раствор с нанокристаллами на молекулярную смесь, они провзаимодействуют с молекулами одной формы, изменят свой оптический отклик и по этому сразу можно определить энантиомерную форму вещества», — отмечает Иван Рухленко.
Однако как разделить сами нанокристаллы с разными видами дефектов? Как найти способы усиления взаимодействия нанокристаллов со светом? Теоретические результаты своей работы ученые опубликовали в двух журналах в мае и июне этого года. В статье, опубликованной в Journal of Applied Physis, студент Никита Тепляков выступил первым автором.
«Если предположить, что нанокристалл изначально не хирален, то, что его делает хиральным, можно рассматривать как малое возмущение электронной подсистемы самого нанокристалла. Никита, используя аппарат квантовой механики — теорию возмущений в общем случае, не конкретизируя взаимодействия, построил теорию, которая позволяет описывать оптическую активность таких нанокристаллов с малым возмущением. Она модифицирует волновые функции нанокристалла. Эта теория может быть применена к нанокристаллам с разными типами хиральности, с винтовыми дислокациями, с неправильной формой, с примесями. В принципе, это применимо и к молекулам. Разработанный метод может оказаться полезным для биофизики, химии и фармакологии», — пояснил Иван Рухленко.
Вторая статья — уже в журнале Optics Letters — была посвящена общему подходу к анализу оптической активности полупроводниковых кристаллов хиральных форм. По словам Ивана Рухленко, большой плюс этой статьи в том, что она позволяет рассчитать асимметрию взаимодействия аналитически — получить конечные формулы. Для того, чтобы это сделать, нужно знать выражения для волновых функций и энергетического спектра носителей заряда внутри нанокристалла. А такое возможно только для нанокристаллов простых форм — для кубика, параллелепипеда, сферы, или цилиндра с непроницаемыми границами. Что же делать, когда у вас нанокристалл не просто неправильной формы, а закрученной, то есть не равен своему зеркальному отражению? Здесь на помощь приходит метод трансформации координат — метод, который изначально использовался для описания возмущенных состояний атомов.
«Мы придумали преобразование координат, которое переводит „неправильные“, но не сильно хиральные нанокристаллы в идеальный нанокубоид. А для него волновые функции мы уже знаем. В свою очередь, зная волновые функции и спектр носителей заряда, мы знаем о квантовой системе все и можем рассчитать любые ее свойства. Данная статья была отмечена тематическим редактором Optics Letters, который написал небольшую заметку, выразив надежду, что наша теория будет вскоре подтверждена экспериментами», — отмечает Иван Рухленко.
Экспериментальные препоны

Разделять нанокристаллы ученые планируют излучением из самых разных диапазонов — все зависит от области, в которой происходит наибольшее поглощение. Есть квантовые точки, которые поглощают излучение видимого спектра. При этом, меняя размер и сохраняя форму нанокристаллов, можно менять длину волны требуемого для разделения излучения.
Сейчас на руках у исследователей есть экспериментальные данные по сульфиду молибдена. После эксфолиации ультразвуком кусочек такого вещества распадается на атомарные и двухатомарные слои. В присутствии хиральных молекул эти слои скручиваются в причудливые формы. Оптический спектр этих скрученных маленьких «листиков» уже есть. Никита Тепляков теоретически предсказал, как достигается подобный эффект. Опубликовать результаты совместной работы ученые планируют в журнале Nano Letters.
Хиральные
Хиральность (молекулярная хиральность) — в химии свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений и перемещений в трёхмерном пространстве.
Наряду с конфигурацией и конформацией хиральность — основное понятие современной стереохимии. Хиральностью обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn
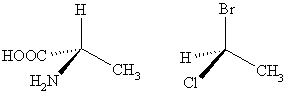
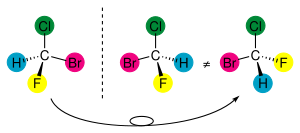
Руки человека – возможно, наиболее распознаваемый пример хиральности: левая рука не накладывается поверх правой руки; неважно, как расположены руки, невозможно, чтобы все главные особенности обеих рук совпали. Разница в симметрии становится очевидной, если кто-то попытается пожать правую руку друга левой рукой или наденет левую перчатку на правую руку. Термин «хиральность» происходит от древнегреческого χειρ – «рука». При использовании в химическом контексте термин «хиральность» обычно относится к молекулам. Два зеркальных отражения молекулы, которые не накладываются друг на друга, относят как к энантиомерам, так и оптическим изомерам. Из-за того, что разница между правой и левой рукой широко известна и легко распознаётся, многие пары энантиомеров именуются право- и леворукими. Смесь равных количеств двух энантиомеров называется рацемичной. Молекулярная хиральность представляет из себя интерес из-за возможностей применения в стереохимии, неорганической химии, органической, физикохимии, биохимии и надмолекулярной химии. Симметрия молекулы (или любого другого объекта) определяет, хиральна ли она. Молекула ахиральна (нехиральна) тогда и только тогда, если у неё есть ось ротоинверсии. Это значит, что если после поворота молекулы на 360° и отражения симметрично плоскости, перпендикулярной оси этого вращения, молекула наложится сама на себя. Хиральная молекула необязательно должна быть симметричной, поскольку, лишённая симметричных элементов, у неё может быть радиальная симметрия.
Содержание
История
Термин «оптическая активность» происходит от взаимодействия хиральных материалов с поляризованным светом. Раствор (-)-формы оптического изомера поворачивает плоскость поляризации света против часовой стрелки. Их исследовал в 1815 году Жан-Батист Биот, и эти исследования принесли ощутимую пользу сахарной индустрии, аналитической химии и фармацевтике. Луи Пастер в 1848 году продолжил молекулярные исследования. Он же и придумал термин «рацемичный», происходящий от латинского названия винограда.
Номенклатура
По оптической активности: +/-.
Энантиомер именуется по направлению света, в котором вращает плоскость поляризованного света. Если вращение происходит по часовой стрелке (по отношению к наблюдателю, к которому направляется свет), то в названии энантиомера отмечается (+). Его зеркальный образ именуется (-). (+)- и (-)-изомеры также определяются как D- и L соответственно (от англ. Dextrorotatory – правоповоротный и Levorotatory – левоповоротный).
По конфигурации: D- и L-.
Оптический изомер может быть назван по пространственной конфигурации его атомов. Система D/L делает это, опираясь на молекулу глицераля. Сам по себе глицераль хирален, и два его изомера именуются D и L. С глицералем можно провести определённые химические манипуляции без изменения конфигурации, и его историческое использование с этой целью (в совокупности с удобством его использования как одной из наименьших широко используемых хиральных молекул) вылилось в его использование в номенклатуре. В этой системе составные части называются по аналогии с глицералем, который, в общем, производит недвусмысленные обозначения, да к тому же и легче всего увидеть в маленьких биомолекулах, похожих на глицераль. Один пример – аминокислота аланин, у которой есть два оптических изомера, и они именуются в соответствии с тем, от какого стереоизомера глицераля они происходят. С другой стороны, глицин, аминокислота, полученная из глицераля, не обладает оптической способностью, поскольку ахиральна. А аланин, тем не менее, хирален. Маркировка D/L не относится к (+)/(-) никаким образом; она не указывает, какой энантиомер правоповоротный, какой – левоповоротный. Однако она сообщает, что стереохимия соединений имеет отношение к тому, что из право- или левоповоротного энантиомеров глицераля правоповоротный будет D-изомером. Девять из девятнадцати L-аминокислот, найденных в протеинах, правоповоротные (длина волны 589 нм), а D-фруктоза называется левулоза, поскольку она левоповоротная. Общая закономерность для определения D/L изомерии аминокислот называется правилом “CORN”. Группы COOH, R, NH2 и H (где R – отличная от других углеродная цепь) выстраиваются вокруг атома углерода хирального центра. Когда смотреть так, чтобы атом водорода был направлен вдаль от наблюдателя, если эти группы расположены по часовой стрелке вокруг атома углерода, то это D-форма. Если против часовой, то L-форма.
Виды хиральности
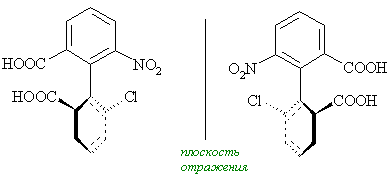
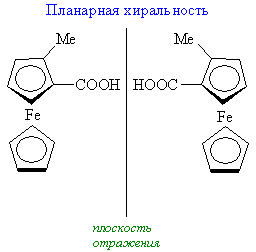
Симметрия любой молекулы определяется как наличием тех или иных взаимосвязей между ее структурными субъединицами, так и характером (то есть идентичностью или неидентичностью) и геометрическим расположением. При этом в молекулах различных классов возможны самые разные типы взаимного расположения составляющих их субъединиц (лигандов) и их структурные сочетания. Однако, каково бы ни было при этом структурное разнообразие возможных молекулярных систем, в молекулах самых различных классов всегда можно выделить то или иное число воображаемых структурных элементов упорядоченности, основными из которых являются точка, ось, плоскость или спираль. Связанные с этими элементами типы хиральности принято подразделять соответственно на:
Наряду с этим широко известны примеры молекул, которые могут содержать сразу несколько элементов хиральности (например, хиральных центров), одновременно являющихся и естественными элементами их структурной упорядоченности. В целом, у хиральных молекул есть точечная хиральность, центрирующаяся вокруг одного атома, у которого четыре разных замещающих группы. Про два энантиомера такого вещества говорят, что у них различные абсолютные конфигурации вокруг этого центра. Этот центр стереогеничен (т.е. группировка внутри организации молекулы может считаться фокусом стереоизомерии), и таким примером являются α-углерод аминокислот. У молекулы может быть несколько хиральных центров, но сама она может быть ахиральной ввиду элемента симметрии (зеркальная плоскость или центр инверсии), который относится к двум или более хиральным центрам. Такая молекула называется мезоизомером. Также возможно, что молекула хиральна и без точечной хиральности. Примером послужит 1,1’-би-2-нафтол (БИНОЛ) и 1,2-дихлораллен, у которых осевая хиральность, и (E)-циклооктен, у которого плоскостная хиральность. Важно помнить, что молекулы, рассеянные в растворе или находятся в газообразном состоянии, обладают значительной гибкостью, и поэтому могут принять множество различных структур. Эти различные структуры сами по себе почти всегда хиральны. Тем не менее, при определении хиральности, надо обязательно использовать структурное изображение молекулы, которое соответствует только одной химической структуре – наиболее симметричной возможной структуре. Когда оптическое вращение энантиомера слишком мало для практического измерения, принято говорить, что наблюдается криптохиральность. Даже изотопные разницы должны учитываться при измерении хиральности. Замена одного из двух атомов 1H на позиции CH2 бензилового спирта дейтерием 2H атом углерода становится стереоцентром. Полученный бензиловый-α-d спирт имеет два отличающихся изомера, что может предназначено для наименований в стереохимии. У S-энантиомера [α]D = +0.715°.
Свойства энантиомеров
Энантиомеры идентичны по отношению к обычным химическим реакциям, но различия появляются, когда они присутствуют в другой хиральной молекуле или объекте. Разные энантиомеры хиральных веществ часто имеют различные запах и вкус и медицинское воздействие (см. ниже). Один хиральный «объект», который по-разному реагирует с двумя энантиомерами хирального вещества, поляризирует свет по кругу: энантиомер поглотит лево- и правополяризованный свет под разными углами. Это основа спектроскопии циркулярного дихроизма (ЦД). Обычно разница в поглощаемости относительно мала (тысячные доли). ЦД-спектроскопия – это мощный аналитический метод, позволяющий исследовать вторичную структуру белка и определять абсолютную конфигурацию хиральных веществ, в частности, переходных металлических комплексов. ЦД-спектроскопия заменяет поляриметрию как метод, характеризующий хиральные вещества, хотя последняя всё ещё популярна в химии сахаров.
Хиральность в биологии
Многие биологические активные молекулы хиральны, включая аминокислоты природного происхождения (строительные блоки протеинов) и сахара. Любопытно заметить, что в биосистемах большинство этих веществ имеют одну и ту же хиральность. Большинство аминокислот L, а сахаров – D. Типичные белки природного происхождения, состоящие из L-аминокислот, известны как белки левой формы, а D-аминокислоты составляют белки правой формы.
Энзимы (а они хиральны) часто различаются между двумя энантиомерами хирального субстрата. Представьте, что у энзима впадина в форме перчатки, которая связывает субстрат. Если перчатка как для правой руки, тогда один энантиомер войдёт вовнутрь и свяжется, в то время как другой энантиомер плохо войдёт, и мало шансов, что свяжется. D-форма аминокислот обычно сладкая на вкус, а L-форма обычно вкуса не имеет. Листья перечной мяты и семена тмина содержат L-карвон и D-карвон соответственно – энантиомеры карвона. Они пахнут по-разному, поскольку обонятельные рецепторы большинства людей также содержат хиральные молекулы, которые ведут себя по-разному в присутствии разных энантиомеров.
Хиральность в фармакологии
Множество хиральных лекарств сделаны с высокой энантиометрической чистотой в связи с побочными эффектами другого энантиомера (который может быть даже неактивным).
Хиральность в неорганической химии
Хиральность аминов
Третичные амины хиральны по принципу, схожему с углеродосодержащими веществами: атом азота несёт четыре разных замещающих группы, включаю одинокую пару. Тем не менее, энергетический барьер инверсии стереоцентра в общем равен около 30 кДж/моль, что значит, что два стереоизомера быстро превращаются друг в друга при комнатной температуре. В результате амины, такие, как NHRR’, не могут быть распознаны по виду, а NRR’R’’ могут быть распознаны, когда R, R’ и R’’ заключены в циклические структуры.
Хиральность в литературе
Ахиральность и прохиральность
Отсутствие хиральности обозначается термином «ахиральность». Ахиральные молекулы могут проявлять индуцированную оптическую активность. Молекулу называют прохиральной, если она может быть превращена в хиральную заменой единственного атома, например, атома водорода в СН2BrCl на фтор. При совмещении в одной молекуле хирального и прохирального фрагментов возникает явление диастереотопии ядер, которое наблюдается в спектрах ядерного магнитного резонанса. На этом основан новейший метод обнаружения хиральности молекул.