Витамин В2 (рибофлавин, витамин роста)
Источники
Достаточное количество содержат мясные продукты, печень, почки, молочные продукты, дрожжи. Также витамин образуется кишечными бактериями.
Суточная потребность
Строение
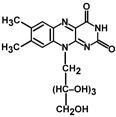
В состав рибофлавина входит флавин – изоаллоксазиновое кольцо с заместителями (азотистое основание) и спирт рибитол.
Строение витамина В2
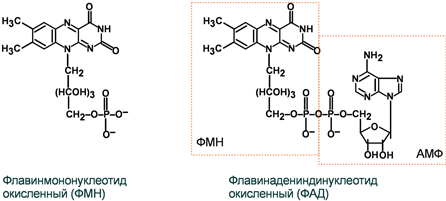
Строение окисленных форм ФАД и ФМН
Метаболизм
В кишечнике рибофлавин освобождается из состава пищевых ФМН и ФАД, и диффундирует в кровь. В слизистой кишечника и других тканях вновь образуется ФМН и ФАД.
Биохимические функции
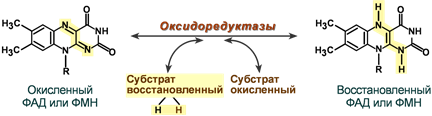
Кофермент оксидоредуктаз – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях.
Механизм участия флавинового кофермента в биохимической реакции
1. Дегидрогеназы энергетического обмена – пируватдегидрогеназа (окисление пировиноградной кислоты), α-кетоглутаратдегидрогеназа и сукцинатдегидрогеназа (цикл трикарбоновых кислот), ацил-SКоА-дегидрогеназа (окисление жирных кислот), митохондриальная α-глицеролфосфатдегидрогеназа (челночная система).
Пример дегидрогеназной реакции с участием ФАД
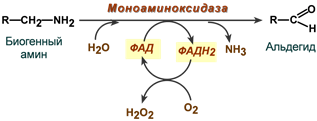
2. Оксидазы, окисляющие субстраты с участием молекулярного кислорода. Например, прямое окислительное дезаминирование аминокислот или обезвреживание биогенных аминов (гистамин, ГАМК).
Пример оксидазной реакции с участием ФАД
(обезвреживание биогенных аминов)
Гиповитаминоз B2
Причина
Пищевая недостаточность, хранение пищевых продуктов на свету, фототерапия, алкоголизм и нарушения ЖКТ.
Клиническая картина
В первую очередь страдают высокоаэробные ткани – эпителий кожи и слизистых. Проявляется как сухость ротовой полости, губ и роговицы; хейлоз, т.е. трещины в уголках рта и на губах («заеды»), глоссит (фуксиновый язык), шелушение кожи в районе носогубного треугольника, мошонки, ушей и шеи, конъюнктивит и блефарит.
Сухость конъюнктивы и ее воспаление ведут к компенсаторному увеличению кровотока в этой зоне и улучшению снабжения ее кислородом, что проявляется как васкуляризация роговицы.
Антивитамины В2
1. Акрихин (атебрин) – ингибирует функцию рибофлавина у простейших. Используется при лечении малярии, кожного лейшманиоза, трихомониаза, гельминтозов (лямблиоз, тениидоз).
2. Мегафен – тормозит образование ФАД в нервной ткани, используется как седативное средство.
3. Токсофлавин – конкурентный ингибитор флавиновых дегидрогеназ.
Лекарственные формы
Свободный рибофлавин, ФМН и ФАД (коферментные формы).
Фад окисленная и восстановленная форма
Определение концентрации флавинадениндинуклеотида (ФАД), являющегося коферментом витамина В2, в образце венозной крови для изучения и оценки обменных процессов и реакций, протекающих с участием этого витамина, и выявления возможных нарушений в них.
Рибофлавин, лактофлавин, флавинадениндинуклеотид (ФАД).
Синонимы английские
Riboflavin, Vitamin B2, Lactoflavin, flavin adenine dinucleotide (FAD).
Высокоэффективная жидкостная хроматография с тандемным масс-спектрометрическим детектированием (ВЭЖХ-МС/МС)
Нмоль/л (наномоль на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Суточная потребность рибофлавина меняется в зависимости от возраста. В среднем для взрослого человека она составляет около 1,7-1,8 мг в день и несколько выше в период полового созревания, беременности, при усиленных физических нагрузках и в пожилом возрасте. Витамин В2 содержится в продуктах растительного (ячмень, овощи, какао) и животного происхождения (молоко, яйца, печень, почки).
Рибофлавин играет важнейшую роль в образовании эритроцитов, компонентов иммунной системы, гормональном контроле роста и половой функции. Также необходим для нормального состояния кожи, ногтей и волос.
При недостаточности рибофлавина повышается риск развития анемии, неврологических нарушений, ухудшения состояния волос, ногтей, кожи, воспалительных и дегенеративно-дистрофических заболеваний глаз. Клинические проявления дефицита витамина В2: дерматит, хейлит (поражение слизистой губ), ангулярный стоматит (трещины в углах рта), глоссит (болезненный язык), конъюнктивит, кератит и в некоторых случаях катаракта. Неврологические нарушения могут быть представлены мышечным напряжением, болями в ногах.
Определение концентрации флавинадениндинуклеотида витамина В2 проводится методом жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Суть его заключается в выделении нужного вещества на основании физико-химических свойств из образца венозной крови, его ионизации и сортировке полученных ионов в зависимости от массы с последующим их анализом. Метод является одним из самых современных, обладает высокой чувствительностью, позволяет анализировать большое количество веществ без ограничения по их физико-химическим свойствам за относительно небольшой промежуток времени.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Причины повышения уровня витамина В2 (ФАД):
Причины понижения уровня витамина В2 (ФАД):
Что может влиять на результат?
Кто назначает исследование?
Терапевт, невролог, офтальмолог, дерматовенеролог, гастроэнтеролог, врач общей практики, эндокринолог.
Биохимические функции ФМН и ФАД



В составе флавиновых ферментов ФАД и ФМН участвуют в многочисленных окислительно-восстановительных реакциях в клетках:
1) участвуют в переносе электронов и протонов в дыхательной цепи;
2) в составе пируватдегидрогеназ и α-кетоглутаратдегидрогеназ участвуют в окислительном декарбоксилировании пирувата и α-кетоглутарата;
3) участвуют в окислении жирных кислот в митохондриях;
4) важная роль флавиновых дегидрогеназ заключается в обеспечении клеток энергией.
Активность флавиновых ферментов осуществляется за счет изоаллоксазинового ядра:
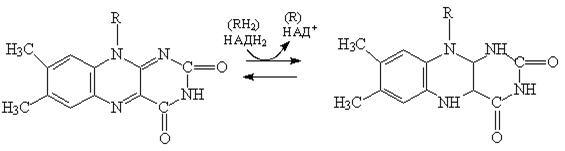 |
ФАД (ФМН) – окисленная ФАДН2 (ФМНН2 ) – восстановленная
форма (желтая) форма (бесцветная)
По положению в дыхательной цепи различают следующие четыре типа флавиновых дегидрогеназ.
1. Вторичные неаутооксидабельные:
RH2 → НАД + ДГ → ФМНДГ → КоQ → цитохромы → 1 /2 О2 → Н2О.
2. Первичные неаутооксидабельные:
4. Первичные аутооксидабельные:
Фад окисленная и восстановленная форма
Развитие представлений о биологическом окислении
Биологическое окисление представляет собой совокупность реакций окисления, протекающих во всех живых клетках. Основной функцией данного процесса является обеспечение организма энергией в доступной для использования форме (прежде всего в форме АТФ).
Принципиальной особенностью биологического окисления, или тканевого дыхания, является то, что оно протекает постепенно, через многочисленные промежуточные ферментативные стадии, т. е. происходит многократная передача протонов и электронов или только электронов от одного соединения-донора к другому-акцептору; при этом протоны транспортируются лишь частью промежуточных переносчиков. У аэробов конечным акцептором электронов и протонов служит кислород.
ИЗ ИСТОРИИ РАЗВИТИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ
Изучение процессов окисления в организме было начато в XVIII веке Лавуазье. Он обратил внимание на наличие известного сходства между процессами горения органических веществ вне организма и дыхания животных. Лавуазье считал, что сущность процесса дыхания состоит в соединении кислорода вдыхаемого воздуха с углеродом и водородом органических веществ внутри тела. После работ Лавуазье в науке в течение долгого времени господствовало мнение о тождестве явлений горения и медленного окисления питательных веществ в организме. Вместе с тем было ясно, что биологическое окисление протекает при весьма необычных условиях: при низкой температуре (температура тела), без появления пламени (как это бывает при горении) и, наконец, в присутствии воды, содержание которой обычно достигает в тканях 75-80%, от сырой массы.
Образующиеся высокомолекулярные перекиси отдают активированный кислород при участии ферментов (пероксидаз) субстрату.
Таким образом, по мнению А. Н. Баха, путь использования кислорода в клетках лежит через образование перекисей, поэтому данная теория получила название перекисной теории окисления. Однако истинный механизм главного пути окисления различных субстратов дыхания оказался иным.
Основные положения о механизме биологического окисления В. И. Палладии пояснил на примере окисления глюкозы:
Суммируя эти два уравнения, получим:
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ
В переносе электронов от субстратов к молекулярному кислороду принимают участие: 1) пиридинзависимые дегидрогеназы, для которых коферментами служат либо НАД, либо НАДФ; 2) флавинзависимые дегидрогеназы (флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН; 3) цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое, или негеминовое, железо.
К числу пиридинзависимых дегидрогеназ относится свыше 150 ферментов, которые катализируют восстановление НАД и НАДФ различными органическими субстратами. Структура НАД была выяснена Эйлером и соавт. Варбургу принадлежит заслуга открытия НАДФ. НАД и НАДФ являются динуклеотидами, в которых мононуклеотиды связаны между собой через остатки фосфорной кислоты. В состав одного из нуклеотидов входит амид никотиновой кислоты (витамин РР), другой представляет собой адениловую кислоту. В молекуле НАДФ имеется еще один остаток фосфорной кислоты, присоединенный к рибозе в положении С3′.
Катализируемые пиридинзависимыми дегидрогеназами реакции можно изобразить так:
В клетках НАД-зависимые дегидрогеназы преимущественно участвуют в процессах, связанных с переносом электронов от органических субстратов к кислороду. В свою очередь НАДФ-зависимые дегидрогеназы играют существенную роль в реакциях биосинтеза (например, высших жирных кислот, сте-ринов и др.). В соответствии с этим коферменты НАД и НАДФ различаются по своей внутриклеточной локализации: НАД концентрируется главным образом в митохондриях, а бoльшая часть НАДФ находится в цитоплазме клеток.
Следующим акцептором атомов водорода является группа флавиновых ферментов, которые осуществляют перенос водородов (протонов и электронов) от восстановленных НАД или НАДФ:
В некоторых случаях (например, при окислении сукцината или жирных кислот) флавиновые ферменты могут играть роль первичных дегидрогеназ, т. е. прямо, без участия НАД- или НАДФ-зависимых дегидрогеназ, принимать электроны и протоны от окисляемых субстратов.
Насчитывается около 30 флавиновых ферментов. Это сложные белки, простетической группой которых, как уже отмечалось, являются либо ФМН, либо ФАД. ФМН и ФАД очень прочно, в отличие от коферментов НАД и НАДФ, присоединены к ферменту (точнее, к апоферменту) и не отщепляются от него ни на одной из стадий каталитического цикла.
Флавиновые дегидрогеназы, входящие в систему дыхательных катализаторов животных клеток, обычно содержат в качестве простетической группы не ФМН, а ФАД. Впервые ФМН и ФАД были выделены Варбургом в середине 30-х годов XX столетия. В это же время Куном был идентифицирован витамин B2 (рибофлавин), который входит в структуру ФАД и ФМН.
Окисленные формы ФМН и ФАД обладают характерным спектром поглощения с максимумом при 450 нм; в окисленном состоянии флавиновые ферменты окрашены в красный, коричневый или зеленый цвет. При восстановлении ФАД и ФМН полоса 450 нм в спектре поглощения исчезает. Активной частью молекулы ФАД или ФМН является изоаллоксазиновое кольцо рибофлавина, к атомам азота которого могут присоединяться два атома водорода, т. е. два электрона и два протона при соответствующей внутримолекулярной перегруппировке двойных связей.
Кофермент Q (убихинон)
Следующим компонентом дыхательной цепи является кофермент Q (KoQ), или убихинон. Этот кофермент впервые был описан Мортоном, который показал, что данное соединение имеет повсеместное распространение в клетках, и назвал его убихиноном. Позже было установлено, что убихинон, подобно НАД и ФАД, может играть роль промежуточного переносчика водородных атомов, т. е. электронов и протонов.
KoQ является производным бензохинона с длинной боковой цепью, которая в большинстве тканей млекопитающих состоит из 10 изопреноидных единиц (KoQ10).
Считают, что восстановленная форма флавиновых ферментов в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) KoQ. Как всякий хинон, KoQ может существовать как в окисленной, так и восстановленной форме:
Приводим структуру простетических групп некоторых цитохромов:
Цитохромы отличаются друг от друга не только своими простетическими группами, но и белковыми компонентами. В ходе каталитического процесса валентность содержащегося в цитохромах железа обратимо изменяется (Fe 2+ Fe 3+ ).
Все цитохромы, особенно в восстановленной форме, имеют характерные спектры поглощения. Величины окислительно-восстановительного потенциала у разных цитохромов также неодинаковы (табл. 24). Например, для цитохрома «с» окислительно-восстановительный потенциал составляет +0,25 В, а для цитохрома «а» +0,29 В. Система 1/2O2/H2O имеет потенциал + 0,82 В. Таким образом, было выяснено, что звено цитохромов располагается в цепи окисления между убихиноном и кислородом; при этом цитохромы в цепь дыхательных катализаторов включаются в определенной последовательности:
В последнее время установлено, что цитохромоксидаза состоит из 6 субъединиц; каждая из них содержит геминовую группу и атом меди. По-видимому, две субъединицы из шести составляют цитохром а, а остальные четыре относятся к цитохрому а3.
| Таблица 24. Окислительно-восстановительные потенциалы некоторых систем дыхательной цепи (в изолированном состоянии, pH 7,0) | ||
| Восстановленная форма | Окисленная форма | Е ‘ 0, В |
| НАДН2 | НАДН | -0,32 |
| ФАДН2-белок | ФАД-белок | -0,05 |
| KoQ-Н2 | KoQ | +0,10 |
| Цитохром b (Fe 2+ ) | Цитохром b (Fe 3+ ) | +0,12 |
| Цитохром с1 (Fe 2+ ) | Цитохром с1 (Fe 3+ ) | +0,21 |
| Цитохром с (Fe 2+ ) | Цитохром с (Fe 3+ ) | +0,25 |
| Цитохром a (Fe 2+ ) | Цитохром a (Fe 3+ ) | +0,29 |
| Н2О | 1/2 O2 | +0,82 |
Как уже отмечалось, иногда цепь биологического окисления может быть укорочена. Имеются флавиновые ферменты, например сукцинатдегидрогеназа, которые способны отнимать водород непосредственно от субстрата. В ряде случаев цепь дыхательного катализатора может иметь еще более простое строение. Так, например, оксидазы L- и D-аминокислот (за исключением глутаматдегидрогеназы), ксантиноксидаза и некоторые другие ферменты катализируют окисление соответствующих субстратов без участия как НАД или НАДФ, так и цитохромов. Эти оксидазы по своей химической природе являются флавопротеидами.
18. Компоненты дыхательной цепи и их характеристика. Фмн и фад-зависимые дегидрогеназы. Строение окисленной и восстановленной форм фмн.
4.ЦИТОХРОМЫ: в, с, c1., а, а3.
Почти все эти компоненты, за исключением первого, встроены во внутреннюю мембрану МИТОХОНДРИЙ.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ.
2.В ФАД и ФМН рабочей частью является ФЛАВИИ (компонент витамина В2)
3.УБИХИНОН легко переходит в восстановленную форму KOQ +2Н +2е =KOQ*H2
Цитохромы электронтранспортной цепи. Их функционирование. Образование воды как конечного продукта обмена.
20. Пути синтеза атф. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
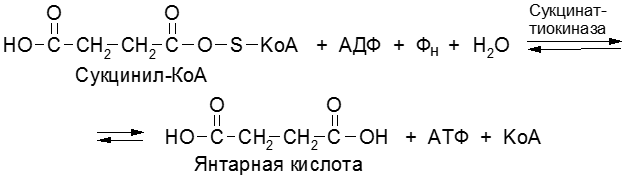
Процесс образования АТФ в дыхательной цепи – окислительное фосфорилирование. За счет энергии транспорта электронов в ДЦ из АДФ и неорганического фосфата образуется АТФ. Субстратное фосфорилирование – процесс синтеза АТФ из АДФ и фосфата за счет энергии окисленного субстрата в цитоплазме клетки. Примером субстратного фосфорилирования могут служить реакции:
Основные положения теории Митчела:
1.Мембрана митохондрий не проницаема для протонов.
2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
Разобщение дыхания и фосфорилирования