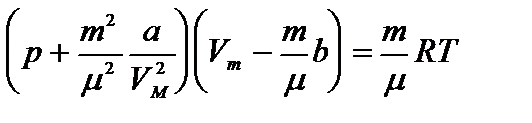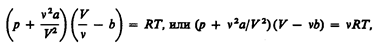Реальные газы. Уравнение Ван-дер-Ваальса. Критическое состояние.
Реальным называется газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Для получения уравнения состояния реального газа необходимо учесть собственный объем молекул и энергию взаимодействия молекул на расстоянии. Наличие собственного объема молекул приводит к уменьшению объема, предоставленного молекулам, на некоторую величину. Силы притяжения между молекулами газа вызывают уменьшение давления молекул газа на стенки сосуда на некоторую величину рi.
Это уравнение может получено путем соответствующего изменения уравнения Менделеева-Клапейрона путем внесения в него поправок.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса) для одного моля имеет вид:
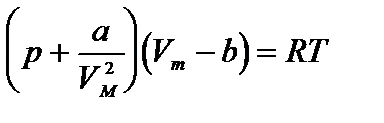
b= 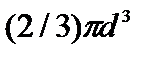
Уравнение Ван-дер-Ваальса для произвольной массы газа имеет вид:
Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа.
Уравнение Ван-дер-Ваальса после нескольких преобразований можно записать в виде:
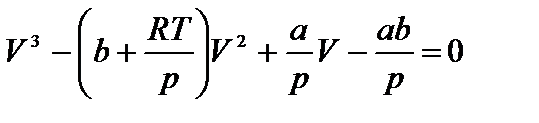
Это уравнение третьей степени относительно V. Кубическое уравнение может иметь либо три вещественных корня, либо один вещественный и два мнимых.
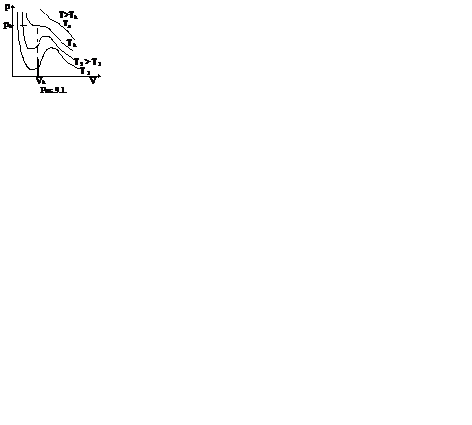
Первому случаю соответствуют изотермы при низких температурах – кривые для Т1 и Т2 (рис.9.1.) Второму случаю изотермы при высоких температурах (одно значение объема V отвечает одному значению давления р), то есть любая изотерма начиная от изотермы для Тк.
Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах (так как при этих условиях газ можно считать идеальным). Для семейства изотерм Ван-дер-Ваальса характерно так называемой критической изотермы (при температуре Тк) имеющий точку перегиба при некотором давлении рк и объеме Vк; при Т>Тк все изотермы идут монотонно, при Т
Уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
Дата добавления: 2015-04-01 ; просмотров: 17509 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Вывод уравнения Ван-дер-Ваальса.
Как уже указывалось, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение состояния Клапейрона—Менделеева 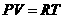
Учитывая собственный объем молекул и сил межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальса (1837—1923) вывел уравнения состояния реального газа. Ван-дер-Ваальс для вывода использовал уравнение Клапейрона—Менделеева в которое ввел две поправки, учитывающие объем молекул и силы из взаимодействия.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не 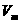
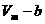
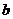
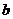
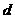
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
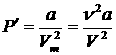
где 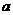
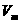
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
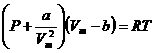
Для произвольного количества вещества 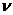
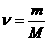
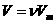
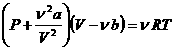
где поправки 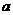
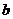
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Поможем написать любую работу на аналогичную тему
§61. Уравнение Ван-дер-Ваальса
Как уже указывалось в § 60, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона—Менделеева (42.4) pVm=RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и сил межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальса (1837—1923) вывел уравнения состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона—Менделеева введены две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, a Vm —b, где b — объем, занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу — учетверенный объем молекулы.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
где а— постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
Для произвольного количества вещества v газа (v=т/М) с учетом того, что V = vVm, уравнение Ван-дер-Ваальса примет вид
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Уравнение Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
§ 62. Изотермы Ван-дер-Ваальса и их анализ
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T>Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление рк называются также критическими. Состояние с критическими параметрами (рк, Vк, Тк) называется критическим состоянием. При низких температурах (Т 3 m-(RT+pb) V 2 m+aVm-ab=0.
Уравнение (62.1) при заданных р и Т является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа V1, V2 и V3 отвечают (символ «т» для простоты опускаем) одному значению давления р1), второму случаю— изотермы при высоких температурах.
(символ «т» для простоты опускаем). Поскольку в критической точке все три корня совпадают и равны Vк, уравнение приводится к виду
Так как уравнения (62.2) и (62.3) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят
диаграмму р, Vm под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9— 10 — растянутой жидкости.
Реальные газы. Уравнение Ван-дер-Ваальса.



Молекулярная физика
Модель идеального газа, используемая в молекулярно-кинетической теории газов, позволяет описывать поведение разреженных реальных газов при достаточно высоких температурах и низких давлениях. При выводе уравнения состояния идеального газа размерами молекул и их взаимодействием друг с другом пренебрегают. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними. Taк, в 1 м 3 газа при нормальных условиях содержится 2,68×10 25 молекул, занимающих объем примерно 10 –4 м 3 (радиус молекулы примерно 10 –10 м), которым по сравнению с объемом газа (1 м 3 ) можно пренебречь. При давлении 500 МПа (1 атм = 101,3 кПа) объем молекул составит уже половину всего объема газа. Таким образом, при высоких давлениях и низких температурах указанная модель идеального газа непригодна.
При рассмотренииреальных газов — газов, свойства которых зависят от взаимодействия молекул, надо учитыватьсилы межмолекулярного взаимодействия. Они проявляются на расстояниях £ 10 –9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называютсякороткодействующими.
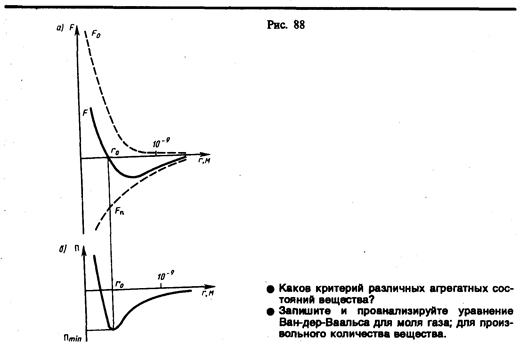
В XX в., по мере развития представлений о строении атома и квантовой механики, было выяснено, что между молекулами вещества одновременно действуютсилы притяжения и силы отталкивания. На рис. 88, а приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, a F —их результирующая. Силы отталкивания считаются положительными, а силы взаимного притяжения — отрицательными.
На расстоянии r=r0 результирующая сила F = 0, т.е. силы притяжения и отталкивания уравновешивают друг друга. Таким образом, расстояние r0 соответствует равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения. При r 0), при r > r0 — силы притяжения (F 10 –9 м межмолекулярные силы взаимодействия практически отсутствуют (F®0).
Элементарная работа dA силы F при увеличении расстояния между молекулами на dr совершается за счет уменьшения взаимной потенциальной энергии молекул, т. е.
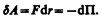
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рис. 88, б) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют (r®¥), то П=0. При постепенном сближении молекул между, ними появляются силы притяжения (F 0).Тогда, согласно (60.1), потенциальная энергия взаимодействия уменьшается, достигая минимума при r= r0. При r 0) резко возрастают и совершаемая против них работа отрицательна (dA=Fdr
Критерием различных агрегатных состояний вещества является соотношениемежду величинами Пmin и kT. Пmin — наименьшая потенциальная энергия взаимодействия молекул — определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (r= r0); kT определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул.
Если Пmin >kT, то вещество находится в твердом состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием r0. Если Пmin»kT, то вещество находится в жидком состоянии, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее r0.

Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причем температура перехода из одного агрегатного состояния в другое зависит от значения Пmin, для данного вещества. Например, у инертных газов Пmin мало, а у металлов велико, поэтому при обычных (комнатных) температурах они находятся соответственно в газообразном и твердом состояниях.
Как уже указывалось в § 60, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона — Менделеева (42.4) pVm=RT (для моля газа), описывающее идеальный газ, для реальных газов непригодны.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, а Vm — b, где b — объем,занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
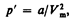
где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя эти поправки, получимуравнение Ван-дер-Ваальса для моля газа(уравнение состояния реальных газов):
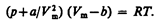
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид
где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Уравнение Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Физика Б1.Б8.
Молекулярная физика и термодинамика
1. Введение
Основы молекулярной физики были заложены трудами Ломоносова, Джоуля, Больцмана, Клаузиуса, Максвелла и других ученых. Благодаря их трудам молекулярная физика прочно утвердилась в науке. Непосредственным опытным подтверждением молекулярно-кинетической теории являются процесс диффузии, броуновского движения, распространения запаха и многие другие явления.
Движение каждой молекулы в веществе может быть описано законами классической механики. Однако число молекул в веществе чрезвычайно велико, направления и величины скоростей молекул совершенно случайны и непрерывно изменяются так, что становится невозможным охватить уравнениями движения всю совокупность молекул и сделать какие-либо выводы об их поведении.
Тем не менее, состояние вещества и его изменение определяется заданием небольшого числа определенных параметров, как температура, давление, объем, плотность и т.д., значения которых невозможно указать на основе решений уравнений классической механики. Дело в том, что свойства огромного числа молекул подчиняется особым, статистическим закономерностям. Статистическая физика изучает статистические закономерности, описывающие поведение большой совокупности объектов. Она основывается на теории вероятностей и позволяет вычислять средние значения величин, характеризующих движение всей совокупности молекул (средние скорости молекул, средние кинетические энергии, средние значения импульса и т. д.) и на этой основе истолковывает свойства вещества, непосредственно наблюдаемые на опыте (давление, температура и т.д.). В этом состоит суть молекулярно-кинетического изучения вещества.
Наряду со статистическим, существует термодинамический метод изучения вещества. В отличие от статистического метода термодинамический метод не интересуется строением вещества. Термодинамика изучают условия превращения энергии и характеризует их с количественной стороны.
В основе термодинамики лежит небольшое число закономерностей, установленных на основе большого числа опытных фактов и получивших название начала термодинамики.
У статистической физики и термодинамики общий предмет изучения – свойства вещества и происходящие в нем процессы. Подходя к изучению этих свойств с разных точек зрения, эти методы взаимно дополняют друг друга.
Совокупность тел, могущих обмениваться энергией между собой и с внешними телами, не входящими в эту систему, называется термодинамической системой. Одним из основных понятий термодинамики является понятие состояния системы. Состояние системы определяется совокупностью значений всех величин, характеризующих физические свойства системы и называемых термодинамическими параметрами (температура, давление плотность, теплоемкость, электропроводность и т. д.). Состояние системы называется стационарным, если значения всех термодинамических параметров не изменяются во времени. Стационарное состояние называется равновесным, если его неизменность не обусловлена протеканием каких-либо процессов во внешних по отношению к данной системе телах.
Исследования показывают, что параметры состояния тел взаимно связаны и могут быть выражены друг через друга. Поэтому термодинамическое состояние задается только ограниченным числом параметров состояния. Такие параметры называются основными параметрами состояния. Важнейшими параметрами состояния химически однородных систем являются плотность, объем, давление, температура. И между этими параметрами существует связь, выражаемая в виде математического уравнения