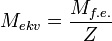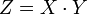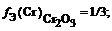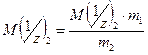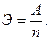Эквивалент. Закон эквивалентов
Материалы портала onx.distant.ru
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Эквивалент (химия)
Эквивалент (химия)
Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H + в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Содержание
Фактор эквивалентности
Эквивалентом является частица ½Zn(OH)2. Число ½ получило название фактора эквивалентности и может обозначаться, как «fэкв«. или «z».
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Молярная масса эквивалента вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Эквивалент — условная частица вещества, в целое число раз Z меньшее формульной единицы (Z — число эквивалентов; показывает, во сколько раз эквивалент меньше формульной единицы).
| вещество | реакция | |||
|---|---|---|---|---|
| простое ˆ | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |
| X | число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |
| Y | характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
ˆ — для инертных газов Z = 1
Закон эквивалентов
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов: все вещества реагируют в эквивалентных отношениях. Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кисло-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Ссылки
Полезное
Смотреть что такое «Эквивалент (химия)» в других словарях:
Эквивалент(химия) — Эквивалент вещества его масса (выраженная в углеродных единицах), которая присоединяет или замещает атомную массу водорода (1,008 г) или половину атомной массы кислорода (15,9994/2 г.) Эквивалент кислоты равен ее молярной массе, деленной на… … Википедия
Эквивалент — – равнозначащий, равносильный продукт. Эквивалентность особенно важна при сравнении товаров и их обмене друг на друга. С этой целью применяются товарные эквиваленты, то есть товары, равноценные другим,… … Энциклопедия терминов, определений и пояснений строительных материалов
ЭКВИВАЛЕНТ ХИМИЧЕСКИЙ — условная частица, в целое число раз меньшая (или равная) соответствующей ей формульной единицы атома, молекулы, иона, радикала и др. В одной формульной единице в ва В может содержаться z(B) Э. х. этого в ва. Число z(B) (эквивалентное число)… … Химическая энциклопедия
ХИМИЯ. РАСТВОРЫ И РАСТВОРИМОСТЬ — Благодаря неравномерному распределению электрического заряда в молекулах, т.е. наличию у них отрицательных и положительных полюсов (если говорить более строго дипольного момента), даже нейтральные в целом молекулы притягиваются друг к другу. Сила … Энциклопедия Кольера
Электрохимический эквивалент — масса вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества: где постоянная Фарадея … Википедия
химический эквивалент — – реальная или условная частица вещества x, которая эквивалентна одному иону водорода в данной кислотно основной реакции или одному электрону в данной окислительно восстановительной реакции. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Углеродный эквивалент — – условная величина содержания углерода, получаемая из набора основных химических элементов арматурной стали. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г. 110 стр.] … Энциклопедия терминов, определений и пояснений строительных материалов
Периодическая законность химических элементов — После открытий Лавуазье (см.) понятие о химических элементах и простых телах так укрепилось, что их изучение положено в основу всех химических представлений, а вследствие того взошло и во все естествознание. Пришлось признать, что все вещества,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ЭКВИВАЛЕНТНАЯ МАССА — (химический эквивалент). Эквивалентная масса элемента это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических… … Энциклопедия Кольера
Что такое химический эквивалент
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
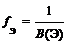
где В(Э) – валентность элемента
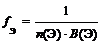
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
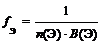
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
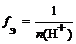
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
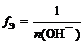
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
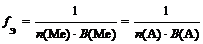
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
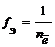
где 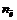
Fe 2+ + 2 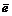
MnO4 – + 8H + + 5 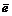
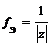
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
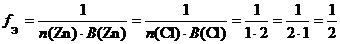
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
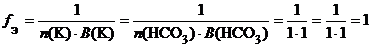
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
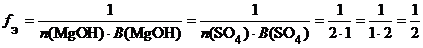
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
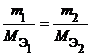
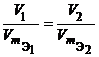
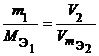
Химический эквивалент
В тех случаях, когда возникает необходимость в проведении большого объема стехиометрических расчетов (химический анализ) удобно пользоваться понятием «химический эквивалент».
Химическими эквивалентами называют условные частицы вещества в целое число раз меньшие, чем соответствующие им формулъные единицы. В химических реакциях эквиваленты равноценны одному атому или иону водорода или одному электрону.
Расчеты с использованием понятия «химический эквивалент» гораздо проще, поскольку согласно закону эквивалентов В. Рихтера (1793 г.) один эквивалент одного вещества всегда взаимодействует с одним эквивалентом другого.
Отсюда следует, что равны и числа эквивалентов реагирующих веществ: Nэк(А) = Nэк(В), а также кратные им количества вещества эквивалентов: nэк(А) = nэк(В)
В формульной единице вещества может содержаться 1, 2, 3, …, а в общем случае zB эквивалентов вещества. zB называется фактором эквивалентности.
В обменных реакциях
Фактор эквивалентности для кислоты равен числу атомов водорода, замещенных в формульной единице кислоты в результате реакции. Фактор эквивалентности основания равен числу гидроксид-ионов замещенных в формульной единице основания в результате реакции.
zB (H3Р04)= 3 zB(K0H) = 1
zB (H3Р04) = 2 zB(K0H) =1
В окислительно-восстановительных реакциях
Значения фактора эквивалентности окислителя и восстановителя равны числам электронов, которые принимает 1 формульная единица окислителя или отдает 1 формульная единица восстановителя.
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТНЫХ ОТНОШЕНИЙ



Общее понятие о химическом эквиваленте.Из пропорциональности количеств элементов и веществ, участвующих в химической реакции, следует, что данному количеству одного из элементов или веществ соответствует определенное количество другого из них. Такие количества называются эквивалентными (равноценными) количествами.
Взятые применительно к установленному стандарту, эквивалентные количества элементов и веществ носят название химических эквивалентов. Впервые понятие об эквиваленте введено в науку в начале XIX в. по отношению к реакциям соединения элементов друг с другом или замещения их друг другом. В дальнейшем это понятие было распространено на все типы реакций.
Из законов кратных отношений и простых объемных отношений с учетом постоянства состава вещества следует, что химические соединения вступают в реакции между собой в определенном количественном соотношении. Следовательно, для простоты расчетов можно принять определенное вещество, его количество или его часть за единицу (эквивалент) и через нее выражать количества других веществ. В качестве такой единицы был принят один атом водорода (или один электрон).
Эквивалентом называется реальная или условная частица вещества, которая может присоединять, высвобождать или быть эквивалентной одному атому водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
В химических соединениях эквивалент вещества (фактор эквивалентности) рассчитывается по формуле:
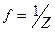
1) числу атомов водорода в бинарном водородсодержащем соединении; числу кислотных протонов в молекуле кислоты;
2) степени окисления атома металла в молекуле основания;
3) числу ионов металла, умноженному на степень их окисления, в молекуле соли;
4) числу атомов элемента, умноженному на степень его окисления, в молекуле оксида.
В химических реакциях эквивалент показывает, какая часть атома, молекулы или иона эквивалентна 1 иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях). Эквивалент данного соединения зависит от конкретной реакции, в которой оно участвует.
Примеры.
Молярная масса эквивалента (эквивалентная масса) — это масса 1 моля эквивалентов вещества. Она рассчитывается по формуле:
Количество вещества эквивалента любого соединения n(1/z) рассчитывается делением массы вещества на молярную массу его эквивалента:
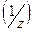
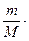
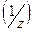
Эквивалентный объем (для газообразных веществ) — это объем 1 моля эквивалентов вещества. Он рассчитывается по формуле:
V 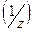
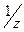
Эквивалентный объем водорода при нормальных условиях равен^
В 1800 г. немецкий химик И. В. Рихтер ввел закон эквивалентных отношений.
Массы веществ, реагирующих без остатка, относятся друг к другу как молярные массы их эквивалентов.
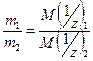
Отсюда следует, что если известны массы взаимодействующих веществ и молярная масса эквивалента одного из них, то можно определить молярную массу эквивалента другого по формуле:
Следствие из этого закона: количества веществ эквивалентов всех участников реакции равны.
Из уравнения 16 следует:
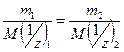
Отсюда с учетом уравнения 14 получаем искомое следствие:
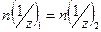
Эквиваленты элементов в реакциях соединения и замещения.При соединении элементов друг с другом и при замещении одних элементов другими в качестве исходного эквивалента берут 8 (точнее 7,9997) единиц массы кислорода или 1 (точнее 1,00797) единицу массы водорода. Поэтому эквивалентом элемента в реакциях этого типа считается количество элемента, соединяющееся с 8 единицами массы кислорода или с 1 единицей массы водорода или замещающее эти количества в соединениях.
Эквивалент элемента может быть вычислен не только по кислороду или водороду, но и по любому другому элементу, с которым он вступает в реакцию. Для этого нужно знать, кроме количеств участвующих в реакции элементов, еще эквивалент элемента, по которому производится расчет.

Например, эквивалент алюминия равен 9, так как его атомный вес 27, а валентность 3; эквивалент меди в соединениях, в которых она одновалентна, равен 63,57, а в соединениях, в которых она проявляет валентность 2, он равен 31,78. Исходя из этой зависимости можно по экспериментально найденному эквиваленту и атомному весу элемента вычислить валентность его в данном соединении.
Зависимость эквивалента элемента от атомной массы элемента и его валентности.Для рассматриваемого типа реакций и соединений эквивалент элемента численно равен частному от деления атомного веса А элемента на проявляемую им валентность п:
Вычисление эквивалентов электролитов по экспериментальным данным.Для вычисления надо знать количества участвующих в реакции веществ и эквивалент одного из них. Расчет производится по закону эквивалентов.