Что такое химия?
Химия исследует строение и свойства вещества, а также происходящих с ним изменений.
Любое вещество бывает либо в чистом виде, либо состоит из смеси чистых веществ. Вследствие химически реакций вещества могут превращаться в новое вещество.
Этапы развития химии, как науки
Химические процессы (получение металлов из руд, крашение тканей, выделка кожи. ) использовались человечеством уже на заре его культурной жизни.
В 3-4 веках зародилась алхимия, задачей которой было превращение неблагородных металлов в благородные.
С эпохи Возрождения химические исследования все в большей степени стали использовать для практических целей (металлургия, стеклоделие, производство керамики, красок. ); возникло также особое медицинское направление алхимии — ятрохимия.
Во второй половине 17 века Р. Бойль дал первое научное определение понятия «химический элемент».
Период превращения химии в подлинную науку завершился во второй половине 18 века, когда был сформулирован закон сохранения массы при химических реакциях.
В начале 19 века Джон Дальтон заложил основы химической атомистики, Амедео Авогардо ввел понятие «молекула». Эти атомно-молекулярные представления утвердились лишь в 60-х годах 19 века. Тогда же А.М. Бутлеров создал теорию строения химических соединений, а Д.И. Менделеев открыл периодический закон.
Если вам понравился сайт, будем благодарны за его популяризацию 
Код кнопки: 
Политика конфиденциальности Об авторе
ХИМИЯ
Смотреть что такое «ХИМИЯ» в других словарях:
ХИМИЯ — (греч. chymeia, от chymos сок). Отрасль естествоведения, исследующая природу и свойства простых тел, частичное влияние этих тел друг на друга и соединения, являющиеся следствием этого влияния. Словарь иностранных слов, вошедших в состав русского… … Словарь иностранных слов русского языка
ХИМИЯ — ХИМИЯ, наука о веществах, их превращениях, взаимодействии и о происходящих при этом явлениях. Выяснением основных понятий, к рыми оперирует X., как напр, атом, молекула, элемент, простое тело, реакция и др., учением о молекулярных, атомных и… … Большая медицинская энциклопедия
ХИМИЯ — (возможно от греч. Chemia Хемия, одно из древнейших названий Египта), наука, изучающая превращения веществ, сопровождающиеся изменением их состава и (или) строения. Химические процессы (получение металлов из руд, крашение тканей, выделка кожи и… … Большой Энциклопедический словарь
ХИМИЯ — ХИМИЯ, отрасль науки, изучающая свойства, состав и структуру веществ и их взаимодействие друг с другом. В настоящее время химия представляет собой обширную область знаний и подразделяется прежде всего на органическую и неорганическую химию.… … Научно-технический энциклопедический словарь
ХИМИЯ — ХИМИЯ, химии, мн. нет, жен. (греч. chemeia). Наука о составе, строении, изменениях и превращениях, а также об образовании новых простых и сложных веществ. Химию, говорит Энгельс, можно назвать наукой о качественных изменениях тел, происходящих… … Толковый словарь Ушакова
химия — – наука о составе, строении, свойствах и превращениях веществ. Словарь по аналитической химии [3] • аналитическая химия коллоидная химия неорганическая химия … Химические термины
ХИМИЯ — совокупность наук, предмет к рых составляют соединения атомов и превращения этих соединений, происходящие с разрывом одних и образованием других межатомных связей. Различные химия, науки отличаются тем, что они занимаются либо разными классами… … Философская энциклопедия
Химия — Наука * История * Математика * Медицина * Открытие * Прогресс * Техника * Философия * Химия Химия Кто не понимает ничего, кроме химии, тот и ее понимает недостаточно. •Лихтенберг Георг (Lichtenberg) (Источник: «Афоризмы со всего мира.… … Сводная энциклопедия афоризмов
Химия — наука о веществах, их составе, строении, свойствах и законах превращений: коллоидная наука о дисперсных системах и поверхностных явлениях на границах раздела взаимодействующих фаз; физическая наука, объясняющая химические явления и… … Энциклопедия терминов, определений и пояснений строительных материалов
Что такое химия? Что означает слово химия?
Что такое химия? Этим вопросом задаются не только те, кому еще предстоит изучать данный предмет в школьном курсе, но и те, у кого это уже в прошлом. Что означает слово химия? Для чего нам курс этой науки в школе?
Что такое химия
С первых уроков химии в школе, мы узнаем, что так называют науку, изучающую, из чего состоят различные вещества и какие свойства имеют. Школьный курс химии рассказывает о превращениях самых разных веществ и дает описание этим процессам, открывая законы по которым это происходит.
Химия представляет собой обширную науку, которую принято разделять на:
Изучение веществ и их преобразование
Повсюду нас окружают вещества, которые растворены в нас и всем, что нас окружает: воздухе, воде и т.д. В природе можно наблюдать превращение различных веществ в абсолютно новые соединения. В качестве примера можно привести наше дыхание, когда мы вдыхаем воздух с растворенным в нем кислородом, который в результате химических реакций насыщается углекислым газом. Обратный процесс мы наблюдаем при фотосинтезе в растениях, когда клетки живого растения поглощают углекислый газ, а в окружающую среду выделяют кислород.
Огромное количество химических реакций происходит в реках и других водоемах. На протяжении тысячелетий в недрах земли образовываются уголь, газ, нефть и различные минералы.
Все эти процессы всегда вызывали интерес у людей. Поэтому ученые пытались найти научное объяснение этим процессом, для чего проводили многочисленные опыты. Проанализировав результаты своих экспериментов, они создавали свои теории. Поэтому химию принято называть экспериментальной наукой.
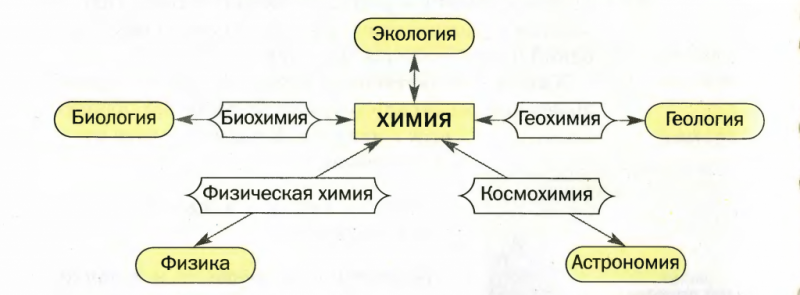
Взаимодействие химии с другими науками
Известно, что естественные науки не только имеют общую связь, они взаимодействуют и дополняют друг друга. Любое преобразование веществ сопровождают физические явления, к примеру, выделение теплоты, ее поглощение и т.д. Этим объясняется взаимосвязь химии и физики.
В процессах, которые происходят в живых организмах, по сути являются обменом веществ. Поэтому биологу для их объяснения тоже нужны знания химии. Геологам такие знания необходимы для исследования земных недр и поиска полезных ископаемых. Медикам, фармацевтам, кулинарам, косметологам химия необходима для работы.
Ученым-химикам тоже необходимы другие науки. К примеру, без математики, они не смогут провести точные расчеты.
В последнее время появилась необходимость в более тщательном изучении взаимодействия различных наук, поэтому были созданы новые науки, имеющие тесную связь с химией: геохимия, агрохимия, коксохимия и т.д.
Химия в нашей жизни
Мы даже не задумываемся о том, что в обычной жизни нас повсюду окружает химия. Во время мытья рук, мыло взаимодействует с водой, создавая вещества, которые способны удалить грязь. Готовя обед, мы из одних веществ формируем другие, которые имеют свой вкус, запах и т.д. Для удаления накипи в чайнике, мы пользуемся столовым уксусом, а для чистки пятен на тканях, применяем лимонный сок.
Знания основ химии позволяет нам понять, что происходит вокруг нас. Без этих знаний просто невозможно грамотно, а главное безопасно использовать различные вещества.
ХИМИЯ
ХИМИЯ, наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей в организме; почему раствор соли проводит электрический ток, а раствор сахара – нет; почему одни химические изменения происходят быстро, а другие – медленно. Главная задача химии – выяснение природы вещества, главный подход к решению этой задачи – разложение вещества на более простые компоненты и синтез новых веществ. Используя этот подход, химики научились воспроизводить множество природных химических субстанций и создавать материалы, не существующие в природе. На химических предприятиях уголь, нефть, руды, вода, кислород воздуха превращаются в моющие средства и красители, пластики и полимеры, лекарства и металлические сплавы, удобрения, гербициды и инсектициды и т.д. Живой организм тоже можно рассматривать как сложнейший химический завод, на котором тысячи веществ вступают в точно отрегулированные химические реакции.
ЭЛЕМЕНТЫ И СОЕДИНЕНИЯ
Элементы
Исследование сложного вещества начинается с попыток разложить его на более простые. Простейшая форма материи, в которой сохраняется определенная совокупность физических и химических свойств, называется химическим элементом. Химические элементы – это частицы вещества, представляющие собой совокупность атомов с одинаковым зарядом ядра. Водород, кислород, хлор, натрий, железо – все это элементы. Элемент нельзя разложить на более простые составляющие обычными методами: с помощью тепла, света, электричества или под действием другого вещества. Для этого нужны колоссальное количество энергии, специальное оборудование (например, ускоритель частиц) или высокие температуры, сравнимые с температурами в недрах Солнца. Из 109 известных элементов в природе существует девяносто два элемента, остальные получены искусственно. Все они систематизированы в периодической таблице элементов, где каждому элементу соответствует свой порядковый номер, называемый атомным номером (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ; ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). В табл. 1 перечислены первые 103 элемента в алфавитном порядке. Из этого ограниченного набора элементов и состоят миллионы химических веществ.
| Элемент | Символ | Атомный номер | Атомная масса |
| Азот | N | 7 | 14,0067 |
| Актиний | Ac | 89 | (227) |
| Алюминий | Al | 13 | 26,98154 |
| Америций | Am | 95 | (243) |
| Аргон | Ar | 18 | 39,948 |
| Астат | At | 85 | (210) |
| Барий | Ba | 56 | 137,33 |
| Бериллий | Be | 4 | 9,01218 |
| Берклий | Bk | 97 | (247) |
| Бор | B | 5 | 10,811 |
| Бром | Br | 35 | 79,904 |
| Ванадий | V | 23 | 50,9415 |
| Висмут | Bi | 83 | 208,9804 |
| Водород | H | 1 | 1,0079 |
| Вольфрам | W | 74 | 183,85 |
| Гадолиний | Gd | 64 | 157,25 |
| Галлий | Ga | 31 | 69,723 |
| Гафний | Hf | 72 | 178,49 |
| Гелий | He | 2 | 4,0026 |
| Германий | Ge | 32 | 72,59 |
| Гольмий | Ho | 67 | 164,9304 |
| Диспрозий | Dy | 66 | 162,50 |
| Европий | Eu | 63 | 151,96 |
| Железо | Fe | 26 | 55,847 |
| Золото | Au | 79 | 196,9665 |
| Индий | In | 49 | 114,82 |
| Иод | I | 53 | 126,9045 |
| Иридий | Ir | 77 | 192,22 |
| Иттербий | Yb | 70 | 173,04 |
| Иттрий | Y | 39 | 88,9059 |
| Кадмий | Cd | 48 | 112,41 |
| Калий | K | 19 | 39,0983 |
| Калифорний | Сf | 98 | (251) |
| Кальций | Ca | 20 | 40,078 |
| Кислород | O | 8 | 15,9994 |
| Кобальт | Co | 27 | 58,9332 |
| Кремний | Si | 14 | 28,0855 |
| Криптон | Kr | 36 | 83,80 |
| Ксенон | Xe | 54 | 131,29 |
| Кюрий | Cm | 96 | (247) |
| Лантан | La | 57 | 138,9055 |
| Лоуренсий | Lr | 103 | (260) |
| Литий | Li | 3 | 6,941 |
| Лютеций | Lu | 71 | 174,967 |
| Магний | Mg | 12 | 24,305 |
| Марганец | Mn | 25 | 54,9380 |
| Медь | Cu | 29 | 63,546 |
| Менделевий | Md | 101 | (258) |
| Молибден | Mo | 42 | 95,94 |
| Мышьяк | As | 33 | 74,9216 |
| Натрий | Na | 11 | 22,98977 |
| Неодим | Nd | 60 | 144,24 |
| Неон | Ne | 10 | 20,179 |
| Нептуний | Np | 93 | 237,0482 |
| Никель | Ni | 28 | 58,69 |
| Ниобий | Nb | 41 | 92,9064 |
| Нобелий | No | 102 | (259) |
| Олово | Sn | 50 | 118,710 |
| Осмий | Os | 76 | 190,2 |
| Палладий | Pd | 46 | 106,42 |
| Платина | Pt | 78 | 195,08 |
| Плутоний | Pu | 94 | (244) |
| Полоний | Po | 84 | (209) |
| Празеодим | Pr | 59 | 140,9077 |
| Прометий | Pm | 61 | (145) |
| Протактиний | Pa | 91 | 231,0359 |
| Радий | Ra | 88 | 226,0254 |
| Радон | Rn | 86 | (222) |
| Рений | Re | 75 | 186,207 |
| Родий | Rh | 45 | 102,9055 |
| Ртуть | Hg | 80 | 200,59 |
| Рубидий | Rb | 37 | 85,4678 |
| Рутений | Ru | 44 | 101,07 |
| Самарий | Sm | 62 | 150,36 |
| Свинец | Pb | 82 | 207,2 |
| Селен | Se | 34 | 78,96 |
| Сера | S | 16 | 32,066 |
| Серебро 2) | Ag | 47 | 107,8682 |
| Скандий | Sc | 21 | 44,9559 |
| Стронций | Sr | 38 | 87,62 |
| Сурьма | Sb | 51 | 121,75 |
| Таллий | Tl | 81 | 204,383 |
| Тантал | Ta | 73 | 180,9479 |
| Теллур | Te | 52 | 127,60 |
| Тербий | Tb | 65 | 158,9254 |
| Технеций | Tc | 43 | [97] |
| Титан | Ti | 22 | 47,88 |
| Торий | Th | 90 | 232,0381 |
| Тулий | Tm | 69 | 168,9342 |
| Углерод | C | 6 | 12,011 |
| Уран | U | 92 | 238,0289 |
| Фермий | Fm | 100 | (257) |
| Фосфор | P | 15 | 30,97376 |
| Франций | Fr | 87 | (223) |
| Фтор | F | 9 | 18,998403 |
| Хлор | Cl | 17 | 35,453 |
| Хром | Cr | 24 | 51,9961 |
| Цезий | Cs | 55 | 132,9054 |
| Церий | Ce | 58 | 140,12 |
| Цинк | Zn | 30 | 65,39 |
| Цирконий | Zr | 40 | 91,224 |
| Эйнштейний | Es | 99 | (252) |
| Эрбий | Er | 68 | 167,26 |
| 1) В расчете на атомную массу изотопа углерода 12 С, равную 12,0000. В круглых скобках указано массовое число наиболее долгоживущего нуклида. 2) См. также АТОМНАЯ МАССА. | |||
Соединения
Элементы, соединяясь друг с другом, образуют сложные вещества – химические соединения. Соль, вода, ржавчина, каучук – это примеры соединений. Соединение состоит из элементов, но обычно по своим свойствам и внешнему виду не напоминает ни один из них. Так, ржавчина образуется при взаимодействии газа – кислорода с металлом – железом, а сырьем для получения многих волокон служат уголь, вода и воздух. Именно индивидуальность свойств – одна из черт, отличающих соединение от простой смеси. Другая, и наиболее важная, характеристика соединения заключается в том, что элементы всегда соединяются между собой в определенных массовых соотношениях. Например, вода состоит из 2,016 массовых частей водорода и 16,000 массовых частей кислорода. Массовое соотношение между водородом и кислородом в водах Волги и льдах Антарктики одинаково и равно 1:8. Иными словами, каждое химическое соединение имеет вполне определенный состав, т.е. всегда содержит одни и те же элементы в одних и тех же массовых соотношениях. Это один из основных химических законов – закон постоянства состава.
Многие элементы образуют несколько соединений. Так, помимо воды известно еще одно соединение водорода и кислорода – пероксид водорода, который состоит из 2,016 частей водорода и 32 частей кислорода. Здесь водород и кислород находятся в массовом соотношении 1:16, что ровно вдвое отличается от их соотношения в воде. Этот пример иллюстрирует закон кратных соотношений: если два элемента образуют между собой несколько соединений, то массовые количества одного элемента, соединяющиеся с одним и тем же массовым количеством другого, относятся между собой как небольшие целые числа.
Атомы и молекулы
Понятия атомов и молекул – основные в химии. Атом – это мельчайшая частица элемента, обладающая всеми его свойствами, а молекула – мельчайшая частица соединения, обладающая его свойствами и способная к самостоятельному существованию. Атомистическая идея восходит к 6–5 вв. до н.э. и принадлежит древнегреческим философам Левкиппу и его ученику Демокриту. По их представлениям, вещество состоит из мельчайших неделимых частиц – атомов, созданных из одного и того же первичного материала. Правда, ни один из этих философов не определил, что это за материал. Впоследствии атомную теорию развил другой греческий философ, Эпикур (4–3 вв. до н.э.). Он утверждал, что атомы обладают весом и перемещаются в горизонтальном и вертикальном направлениях, взаимодействуя друг с другом. Аналогичные идеи высказывал римский поэт Лукреций в 1 в. до н.э., наблюдавший за пылинками, которые танцуют в солнечном луче. Наконец, в 1804–1810 английский химик и физик Дж.Дальтон разработал атомную теорию, которая включала законы кратных соотношений и постоянства состава. Однако убедительные доказательства существования атомов были получены только в 20 в. Когда Лукреций утверждал, что пылинки подталкиваются невидимыми потоками движущихся атомов, он был не так уж далек от истины: их танец действительно могут вызывать воздушные течения, но даже в неподвижном воздухе частички пыли или дыма находятся в постоянном движении. Этот эффект называют броуновским движением (см. также БРОУНОВСКОЕ ДВИЖЕНИЕ). Спустя два тысячелетия после Лукреция французский ученый Ж.Перрен, вооруженный микроскопом и математической теорией, изучил случайные блуждания суспендированных частичек краски и рассчитал число невидимых молекул, чьи удары заставляли их двигаться. После того, как атомы и молекулы удалось сосчитать, само их существование стало гораздо более убедительным.
Строение атома
Согласно современным представлениям, атом содержит центральное ядро, размеры которого очень малы по сравнению с атомом в целом. Ядро несет положительный электрический заряд и окружено диффузной оболочкой (облаком) из отрицательно заряженных электронов, которая и определяет размер атома. Диаметр атома – ок. 10 –8 см, диаметр ядра в 10 000 раз меньше и равен примерно 10 –12 см. У простейшего из атомов – атома водорода – в ядре всего одна частица – протон. Ядро атомов других элементов содержит более одного протона, а также нейтроны – частицы, близкие к протонам по массе, но не имеющие электрического заряда. Заряд ядра называют его атомным (или порядковым) номером. Атомный номер равен числу протонов в ядре и определяет химическую природу элемента. Так, атом с зарядом ядра +26 содержит 26 протонов в ядре и представляет собой элемент железо. Ядро атома железа окружают 26 электронов, поэтому атом в целом электронейтрален.
Суммарное число протонов и нейтронов в ядре называют массовым числом, поскольку в этих частицах сосредоточена практически вся масса атома. Число нейтронов, содержащихся в ядрах атомов данного элемента, в отличие от числа протонов, может варьировать. Атомы одного элемента, ядра которых содержат разное число нейтронов, называют изотопами. Слово «изотоп» греческого происхождения; оно означает «одно и то же место» – разные изотопы элемента занимают одну и ту же позицию в периодической таблице Менделеева (см. также ИЗОТОПЫ) и обладают очень близкими химическими свойствами. Так, у водорода (массовое число 1) есть изотоп дейтерий, в ядре которого один протон и один нейтрон (массовое число соответственно равно 2). Оба изотопа вступают в одни и те же химические реакции, но не всегда одинаково легко.
Термин «атомная масса» означает массу атома элемента, выраженную в единицах массы атома изотопа углерода 12 С, которую принято считать равной его массовому числу – 12,0000 (атомная масса изотопа близка к его массовому числу, но не равна ему, поскольку при образовании атомного ядра часть массы теряется в виде энергии). До 1961 атомные массы элементов определяли относительно среднего массового числа для смеси изотопов кислорода, равного 16,0000. Атомная масса элемента, существующего в природе в виде смеси изотопов, – это средняя величина атомных масс всех изотопов с учетом их распространенности в природе (см. также АТОМНАЯ МАССА). Молекулярная масса равна сумме масс атомов элементов, составляющих молекулу. Например, мол. масса воды равна сумме 2 · 1,008 (два атома водорода) + 16,0000 (один атом кислорода), т.е. 18,016.
Электронное облако
Физические и химические свойства атомов, а следовательно, и вещества в целом во многом определяются особенностями электронного облака вокруг атомного ядра. Положительно заряженное ядро притягивает отрицательно заряженные электроны. Электроны вращаются вокруг ядра так быстро, что точно определить их местонахождение не представляется возможным. Движущиеся вокруг ядра электроны можно сравнить с облаком или туманом, в одних местах более или менее плотным, в других – совсем разреженным. Форму электронного облака, а также вероятность нахождения электрона в любой его точке можно определить, решив соответствующие уравнения квантовой механики (см. также КВАНТОВАЯ МЕХАНИКА). Области наиболее вероятного нахождения электронов называют орбиталями. Каждая орбиталь характеризуется определенной энергией, и на ней может находиться не более двух электронов. Обычно вначале заполняются ближайшие к ядру самые низкоэнергетические орбитали, затем орбитали с более высокой энергией и т.д.
Существует четыре типа орбиталей, их обозначают s, p, d и f. На каждом уровне (слое) имеется одна s-орбиталь, которая содержит наиболее прочно связанные с ядром электроны. За ней следуют три p-орбитали, пять d-орбиталей и, наконец, семь f-орбиталей.